钛及钛合金屈服强度高、密度低,具有良好的力学性能,优异的耐蚀性和抗冲刷性,[1−2],广泛运用于海洋工程领域,特别是海水管路和海水冷却发电装置等[3−5]。虽然钛合金具有良好的耐蚀性,但在恶劣的海洋环境中同样面临着海水腐蚀问题。海水腐蚀是由多种因素造成的,包括:盐度、温度、pH以及生物污损等,其中生物污损是最重要的因素之一[6]。
生物污损是一个复杂的过程,涉及微生物(包括细菌、原生动物和微藻)和大型污损生物(包括藤壶、牡蛎等大型无脊椎动物和大型藻类)[7−8]。微生物在材料表面附着会诱发腐蚀(MIC),这已经被广泛研究[9−13]。如钛合金在流动海水中形成的生物薄膜约20~50µm,短期内对材料具有保护作用[14]。Shewanella藻类通过削弱钛合金钝化膜,使Cl−更具侵略性,加剧腐蚀[15]。嗜盐菌N.tibetense在Q235钢表面非均匀局部聚集,形成氧浓差腐蚀电池诱发局部腐蚀,且N.tibetense能以Fe为能源物质获取电子,加速电化学反应的电荷转移,进而加速腐蚀进程,氧浓度差腐蚀电池和N.tibetense对铁金属直接消耗两种机制耦合共同促进碳钢腐蚀[16]。细菌产生的胞外聚合物质(EPS)可以使B30铜镍合金表面形成较厚双氧化层(外层沉积Cu2O层和内部氧化镍层),有效减缓试样腐蚀速率[17]。微生物附着对金属的腐蚀影响已经得到很好的研究,不同微生物的生命活动对不同金属材料的腐蚀行为亦有所差异[18−21]。马士德等[22]在三亚对工业纯钛(TA2)进行海水腐蚀研究,结果表明致密、稳定的钛氧化物膜起到了防腐作用,但污损生物群落演替导致防腐作用难以保证长期性和稳定性,尤其是局部环境。同时,已有研究表明,大型污损生物短期内对不锈钢具有保护作用,但大型污损生物一般是长期且不均匀附着,易在污损生物与金属材料的边缘缝隙间形成氧浓度差,从而导致局部腐蚀[23−25]。在以往大型污损生物研究中,研究材料一般为不锈钢和碳钢,缺乏对钛合金的研究和分析[26−27]。不同材料受海水理化性质和污损生物群落演替影响,腐蚀行为存在差异,且海水中材料腐蚀和污损生物的生命活动高度依赖特定的地理位置[28]。实验室中通过培养污损生物进行研究往往不能还原特定海域的海水理化性质和生物多样性。因此有必要在亚热带湛江湾实海研究污损生物附着行为对钛合金的腐蚀影响。
本研究选取TC4钛合金在湛江调顺岛实海中挂样,观察污损生物附着行为以及试样腐蚀形貌,结合电化学测试和XRD研究污损生物附着对TC4钛合金的腐蚀影响,探索生物腐蚀机理,为钛合金在海洋工程装备应用提供一定的理论和参考。
1、实验材料和方法
1.1实验材料
TC4钛合金化学成分如表1所示。

1.2实验方法
1.2.1样品制备
试样加工尺寸为Φ56mmφ3mm,用240#、400#、800#、1000#砂纸将试样表面打磨平整,将试样浸泡在丙酮中,放入超声波清洗仪清洗15分钟后,使用无水乙醇和蒸馏水对试样进行洗涤,干燥封装、编号后放入干燥箱备用。试样密封装置采用带螺纹管节,内部装有金属试样,使用弹簧将导线压在金属试样表面,管节一端使用环氧树脂密封,另一端采用密封圈密封。由于密封作用,试样实际上只有一面暴露于海水中。
1.2.2实验内容与方法
样品封装后,于2022年9月6日投放在广东湛江调顺岛海域,浸入海水中深度为2m,该海域全年月平均水温16.3℃32.6℃,盐度24.2‰26.9‰,pH8.108.22,浊度8.60FTU~13.6FTU。该海域涨、落潮平均流速分别为0.2m/s和0.24m/s,涨潮流速小于落潮流速,其比值为0.84。其中,大潮涨、落潮段平均流速分别为0.27m/s和0.30m/s;小潮涨、落潮段平均流速分别为0.14m/s和0.18m/s。
本实验分为8组,每组设置3个平行样,取样周期为5、10、20、30、45、60、75和90d,每个实验周期都从海水中取回3个平行样,首先进行电化学测试,电解池采用三电极体系,参比电极(RE)为饱和KCl甘汞电极(SCE),辅助电极(CE)为20mm×20mm×0.2mm铂电极,试样为工作电极(WE),有效面积24.62cm2,电解质为海水。在开路电位下对试样进行EIS测试,频率范围为0.01~105Hz,信号幅值为5mV正弦波。极化曲线扫描速率为0.5mV/s,扫描区间±0.01V(相对开路电位),采用Zview软件对EIS进行等效电路拟合和分析。接着使用Nikon数码相机拍摄宏观形貌,将螺纹管节拆开取出试样,采用XRD对试样各个浸泡阶段腐蚀产物进行分析,扫描2角度10°~90°,扫描速率4(°)/min,步长0.04。
藤壶等大型污损生物使用镊子去除钙质外壳后,蒸馏水反复冲洗,然后按照GB/T16545-2015《金属和合金的腐蚀腐蚀试样上腐蚀产物的清除》配置除锈液去除藤壶基板和清洗试样表面,接着用无水乙醇洗涤,最后用蒸馏水洗涤,干燥,最后使用徕卡超景深显微镜观察表面微观形貌。
2、结果与分析
22.1样品形貌观察与分析
图1是TC4钛合金在海水中浸泡不同时间的宏观形貌。5d,试样表面依然光亮,有幼体藤壶附着。10d,藤壶基底直径增大,“生物泥”肉眼可见。20d,藤壶数量与个体呈上升趋势,个别藤壶基底直径达7mm,试样约50%面积被覆盖,“生物泥”厚度明显增大,水螅、管栖多毛类泥管和石灰质管等开始附着,这些均为我国南海污损生物季节性优势物种[29],也是“生物泥”主要构成,如图2所示。“生物泥”的形成是细菌和硅藻等微生物膜加上有机或无机颗粒的运动、黏附和沉积作用,使微生物膜增厚形成“生物泥”[22]。30~45d,未观察到其他新物种附着,藤壶基底直径增大、数量增加,覆盖面积达90%以上,表明钛合金具有较好的生物相容性,是海洋生物的理想栖息地[30]。同时,部分藤壶死亡形成空壳,藤壶空壳在海水冲刷下脱落,但藤壶基底并未脱离试样,表明藤壶胶具有较强粘性[31−32]。


60~75d,此时藤壶依然是试样表面污损生物的优势物种,此时污损生物覆盖面积比高达99%。温差过大可造成藤壶大面积死亡[33−36],而本实验是在秋冬季进行,75~90d时湛江海域进入冬季,受季节影响温度骤变,导致藤壶大部分死亡,死亡率达95%。
图3是TC4钛合金在海水中浸泡不同时间藤壶附着数量及面积占比。从图中可以看出10d时藤壶附着数量最少,为1.3pcs/cm2,结合图1可知在试验初期,试样表面较为光滑,幼体藤壶附着强度较小[33],部分幼体藤壶在海水冲刷下脱落或死亡脱落。20d时,试样表面藤壶数量明显增多,个体基底直径明显增大。随着试验时间延长,试样表面粗糙度和“生物泥”厚度逐渐增大,且部分藤壶生长成熟,开始繁殖[37],使得试样表面藤壶附着数量在30d时最多,为4.5pcs/cm2。之后藤壶基底直径不断增大,附着空间被压缩,幼体藤壶挤压脱落以及部分藤壶死亡脱落,藤壶附着数量波动变化,但整体覆盖面积占比几乎不变。
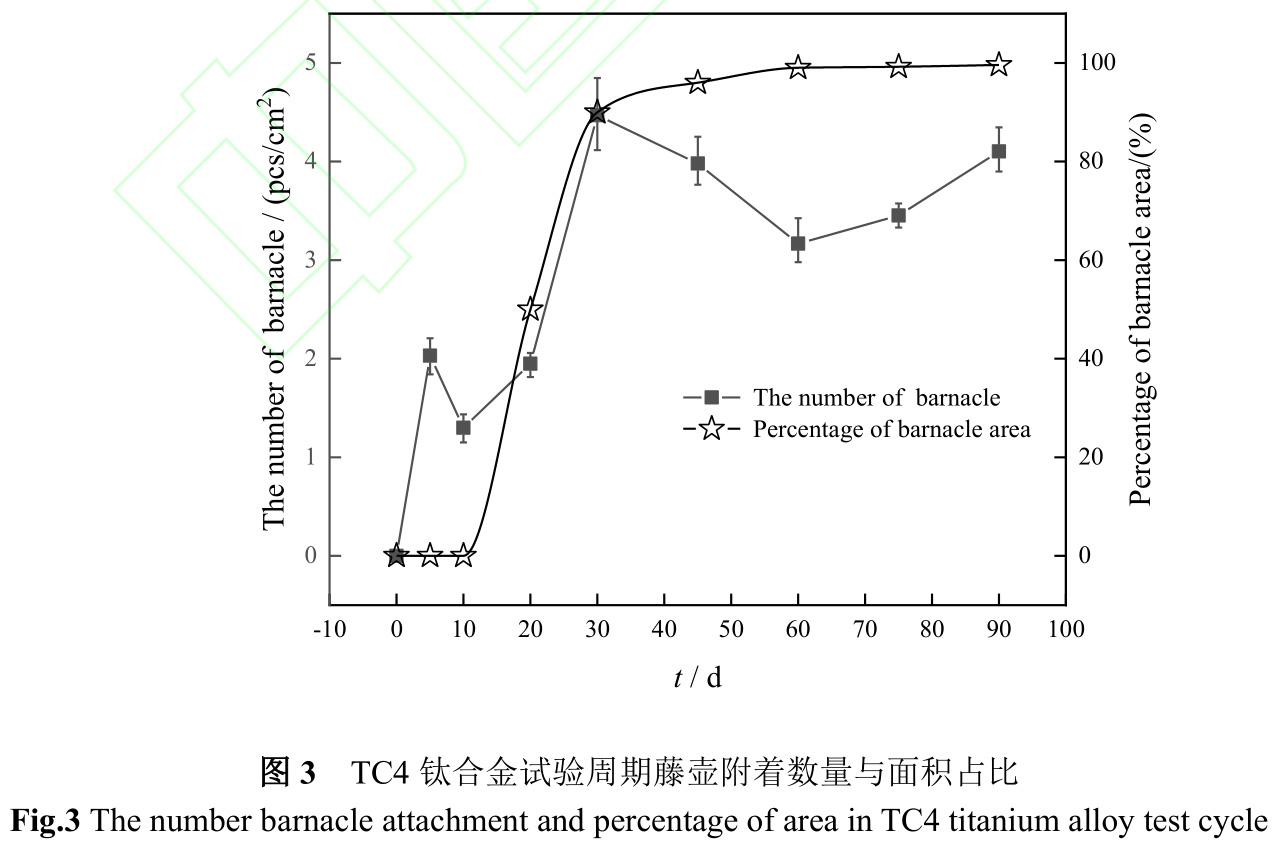
图4是TC4钛合金去除表面附着物后的微观形貌图。结合图1和图4可知,在海水中浸泡的前10d,钛合金表面主要是由微生物组成的生物膜,同时也是钛合金钝化膜形成阶段,微生物膜的形成造成介质不均匀性导致钛合金钝化膜不均匀,表面呈现密集的小而浅的缺陷;在海水中浸泡30d后,钛合金表面主要污损生物演替为藤壶,随藤壶生长与死亡,在生长过程中藤壶体现较好的阻隔作用,钛合金钝化膜基本完整,表面呈现小而浅的缺陷;藤壶死亡后,藤壶阻隔性下降,藤壶内部有机质分解造成低氧海水环境,从而使钛合金钝化膜再生困难,并且藤壶下钛合金与藤壶外钛合金之间形成强烈的氧浓差,构成氧浓差电池,藤壶下钛合金发生较快腐蚀,呈现大而深的腐蚀坑。

图5是试样表面3D微观图。试验中后期(45~90d),试样表面无藤壶附着位置或藤壶与藤壶空隙之间无明显蚀坑,而藤壶附着位置出现蚀坑。随着时间延长,藤壶附着位置点蚀更加密集或形成溃疡坑,60d时溃疡坑直径高达1.5mm,90d时蚀坑最深可达0.14mm。

藤壶引起腐蚀需要具备三个条件:附着藤壶死亡、微生物对死亡藤壶有机体作用和构成宏观电池[38]。海洋污损生物附着以及生命活动新陈代谢产生大量代谢产物和酸性物质,富集在试样表面形成生物膜,从而在金属和生物膜之间形成局部厌氧区,进而破坏钝化膜,为海水中腐蚀性离子提供通道,促进腐蚀[39]。由图1和图5可知,藤壶在30d开始出现死亡,钙质外壳被破坏和有机体被海水中微生物分解,为Cl−与材料表面的接触、传输提供路径,从而导致钝化膜破裂。同时藤壶壳内第一触角位置易形成活化点成为阳极与壳外金属作为阴极构成宏观电池,促进局部腐蚀。不同生长阶段的藤壶对TC4钛合金的腐蚀机制有所不同,结构完整的活体藤壶钙质外壳和致密藤壶胶能够有效隔离外界腐蚀介质,死亡藤壶则因壳体结构不完整与有机体被微生物分解,反而促进腐蚀。
2.2电化学测试结果与分析
(1)极化曲线
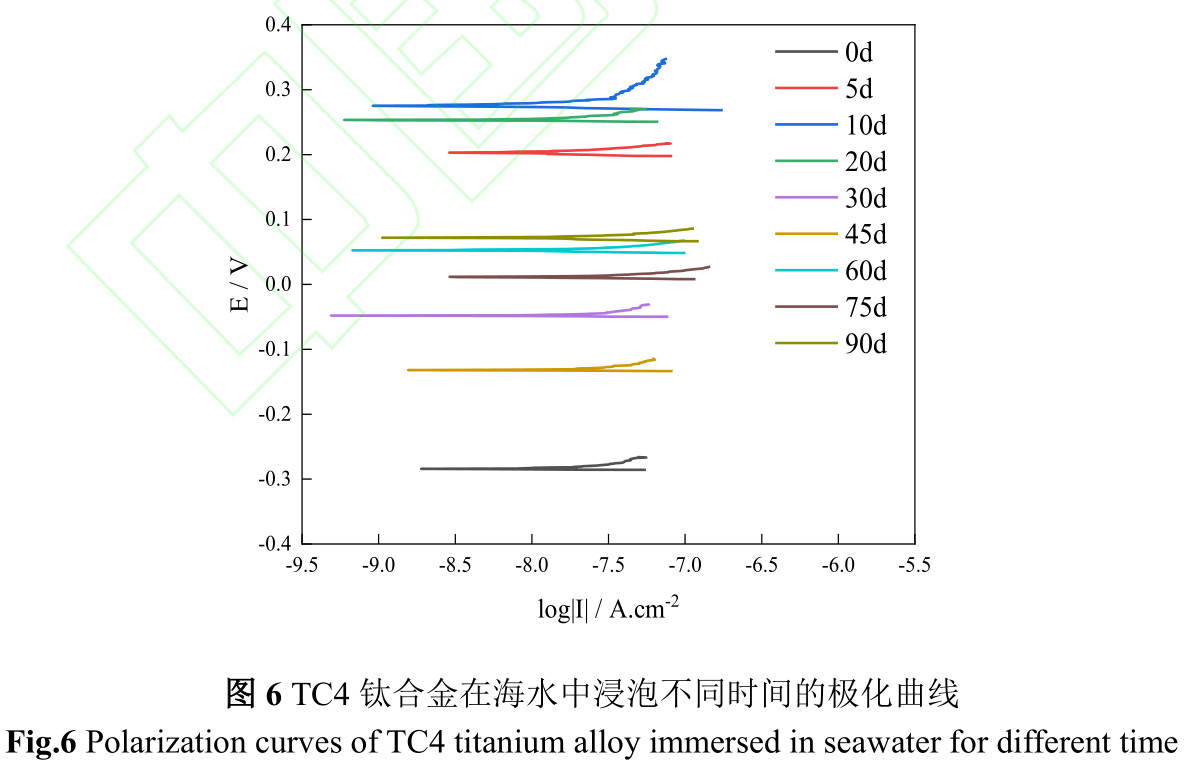
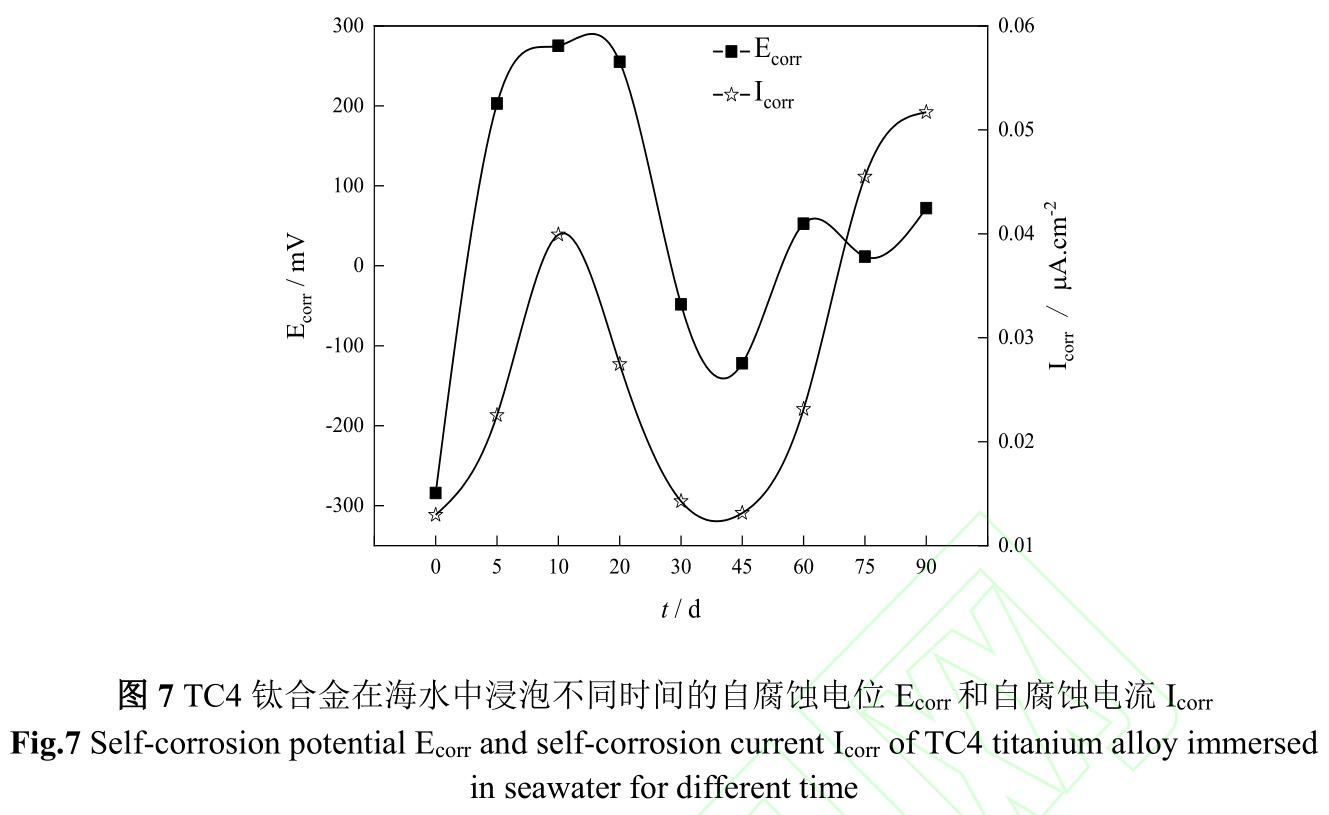
图6是TC4钛合金在海水中浸泡不同时间极化曲线,图7是TC4钛合金在海水中浸泡不同时间的自腐蚀电位(Ecorr)和自腐蚀电流(Icorr)。由图6、7可知,TC4钛合金在海水中初始腐蚀电位较负,为−284.2mV,随着试验时间延续,腐蚀电位急剧正移,腐蚀电流伴随腐蚀电位而升高,在第10d,腐蚀电流达到最大,该阶段金属表面阳极溶解过程加速,从而增加了钛合金腐蚀速度。第10d至45d,钛合金腐蚀电位逐渐下降,腐蚀电流亦逐渐下降,结合图1污损生物由微生物、小型生物组成生物淤泥层向以藤壶为主要的大型污损生物层转变,金属表面阳极溶解过程受到抑制,从而减缓钛合金腐蚀速度。第45d后,以藤壶为主的大型污损生物大面积死亡,改变了钛合金表面腐蚀环境,导致腐蚀电位升高的同时腐蚀电流也升高。
(2)EIS
图8为TC4钛合金在海水中浸泡不同时间的EIS图。由图1、2、7和图8中的Nyquist图可知,TC4钛合金在浸泡初期(0~10d),生物膜附着与金属表面钝化膜致密化同时发生,容抗弧半径先减小再增大,第10d时达到最大,此时材料耐蚀性较好。试验中期(20~45d),容抗弧半径逐渐减小,但幅度相对较小,生物膜的形成-脱落以及藤壶为主大型污损生物的附着-生长,影响了钝化膜再生。试验后期(60~90d),容抗弧半径波动变化但明显小于试验前中期(0~45d),表明试验后期材料耐蚀性较差,腐蚀趋势较大。

为定量分析TC4钛合金与溶液界面之间的变化关系,采用图9的等效电路图对EIS进行拟合。试样浸泡前,表面没有生物膜和污损生物附着,采用单层膜模型Rs(CPE1Rct),试样浸泡到海中,生物膜和污损生物的影响采用双层膜模型Rs(CPE1(Rf(CPE2Rct)))。其中,Rs是溶液电阻,CPE1是膜电容,Rf是膜电阻,Rct是电荷转移电阻,CPE2是溶液双电层电容。以Rs(CPE1Rct)和Rs(CPE1(Rf(CPE2Rct)))两种物理模型拟合的等效电路参数如表2所示。

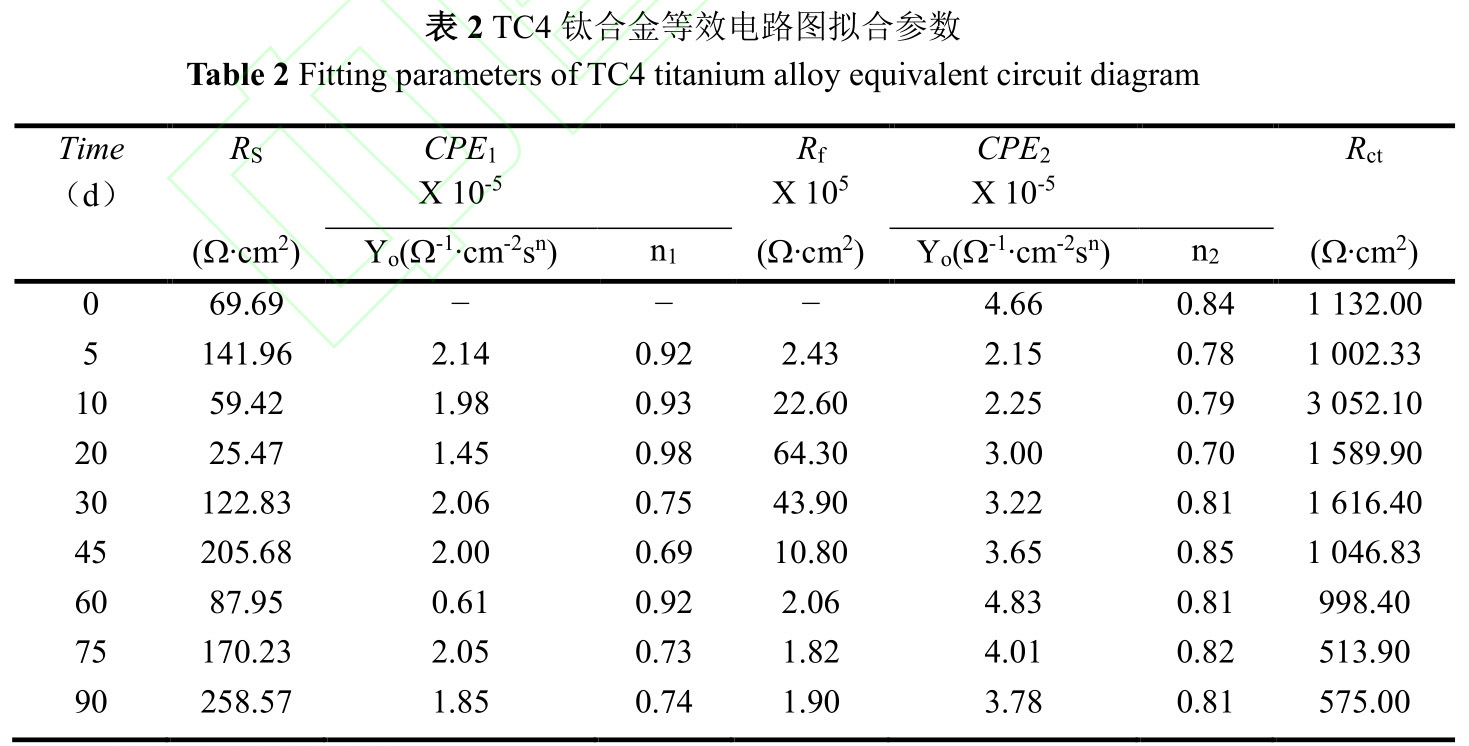
电化学测试溶液取自海中,不同试验周期海水浊度、盐度等理化参数受气候影响并不一致,导致溶液体系相对不稳定,其中溶液电阻Rs最大值为258.57Ω.cm2,最小值为25.47Ω.cm2,最大偏差为233.1Ω.cm2。Rp为极化电阻,等于电荷转移电阻Rct与膜电阻Rf的代数和,用于衡量材料抵抗腐蚀介质穿透能力的大小,与金属腐蚀速度呈负相关。从拟合结果来看,在试验初期(0~10d),第5d的Rp明显小于第10d,表明浸泡初期钝化膜致密性较差,该阶段污损生物膜附着与钛合金表面钝化膜增厚、致密化过程。第10d至45d的Rp依旧处于较高水平,结合图1可知第10d后污损生物由微生物、小型生物组成生物淤泥层向以藤壶为主要污损生物的大型污损生物层转变,大型污损生物层相对生物淤泥层输氧效率高,钝化膜再生能力较强,阻滞了阳极溶解,腐蚀速度有所降低。试验后期(60~90d),藤壶大量死亡,死亡藤壶造成钛合金表面介质性质不均匀化[40],影响钛合金表面钝化膜形成与再生,使Rp降低,从而导致腐蚀速度增大。整个试验中,污损生物附着影响钛合金表面钝化膜的形成与再生,从而影响整个腐蚀进程。
2.3腐蚀产物及机理分析
图10是TC4钛合金在海水中浸泡不同时间的XRD图。TC4钛合金为钛铝合金,在海水环境中,TC4钛合金表面形成含有TiO2和Al2O3的钝化膜,而CaCO3主要来源于钙质外壳污损生物。CaCO3衍射峰从第10d出现,到第20d峰型尖锐,此演变规律与污损生物演替规律相同。在20~45d期间,CaCO3衍射峰呈增强-减弱-增强的波动变化,这是因为钙质外壳污损生物局部附着,而XRD分析区域与钙质外壳污损生物附着区域错致所致。
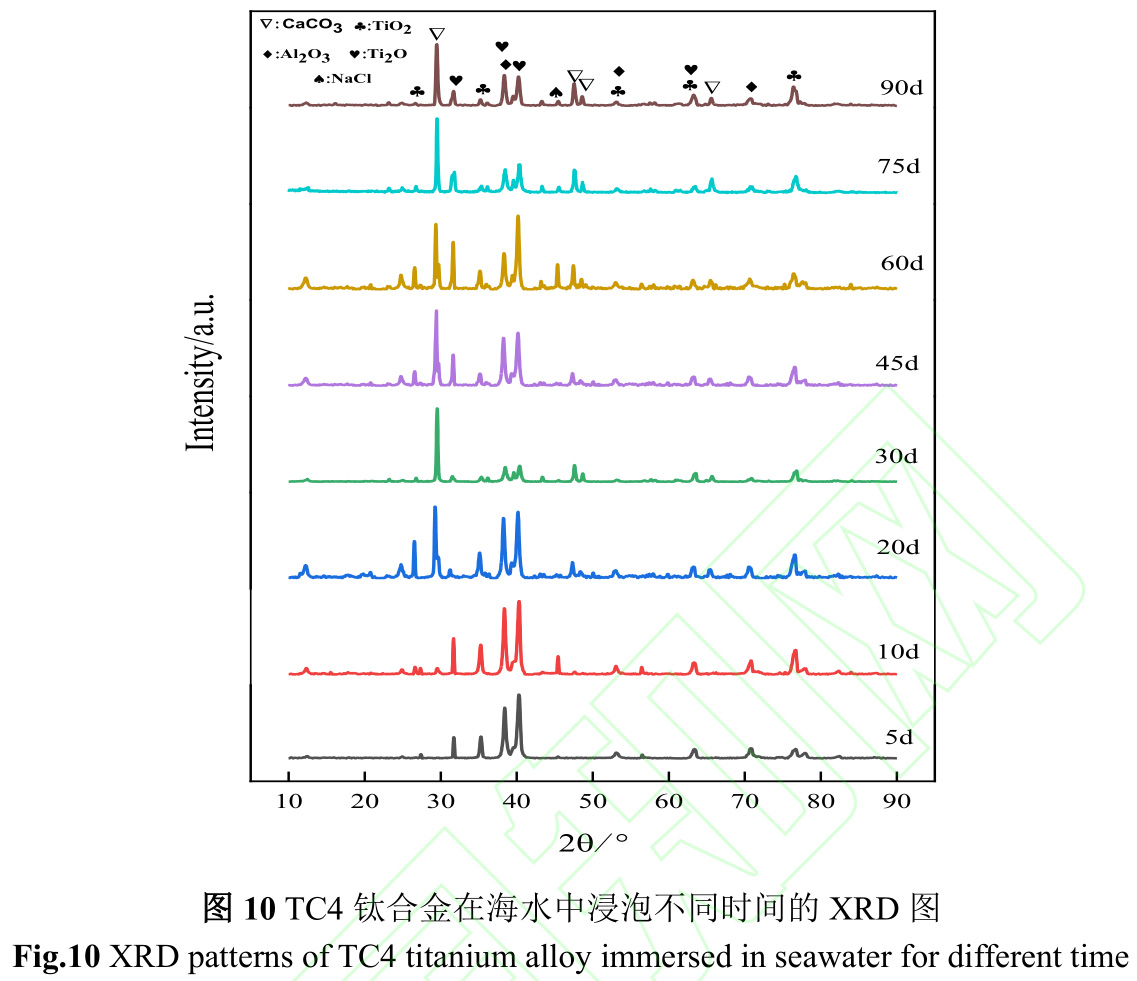
图11是TC4钛合金在海水中的腐蚀机理图。钛合金具有优良的耐蚀性是因为表面易形成钝化膜,钛合金在海水中钝化反应如下:
Ti+2H2O→TiO2+4H++4e−(1)
2TiO2+2H++2e−→Ti2O3+H2O(2)
Ti2O3稳定性较差,会再次被氧化成TiO2:
Ti2O3+H2O→2TiO2+2H++2e−(3)
钛合金钝化和污损生物附着几乎同时发生。Venkatesan等[41]研究表明海洋污损生物附着是长期且复杂的自然选择、生态演替过程。通常材料浸没在海水后,几分钟内被多聚糖和糖蛋白等有机分子与无机化合物快速黏附,形成基膜。浮游细菌利用范德华力等弱作用力在基膜上附着,通过新陈代谢产生具有黏性的细胞外高聚物[42],使附着逐渐牢固,最终形成生物膜。生物膜形成为藤壶幼虫等大型污损生物附着提供了良好条件。生物膜形成和大型污损生物附着使试样表面形成“生物封闭滞留层”,试样不再直接与海水接触。“生物封闭滞留层”是封闭或半封闭状态,污损生物在试样表面所占面积越大,对材料整体性保护越好[43]。
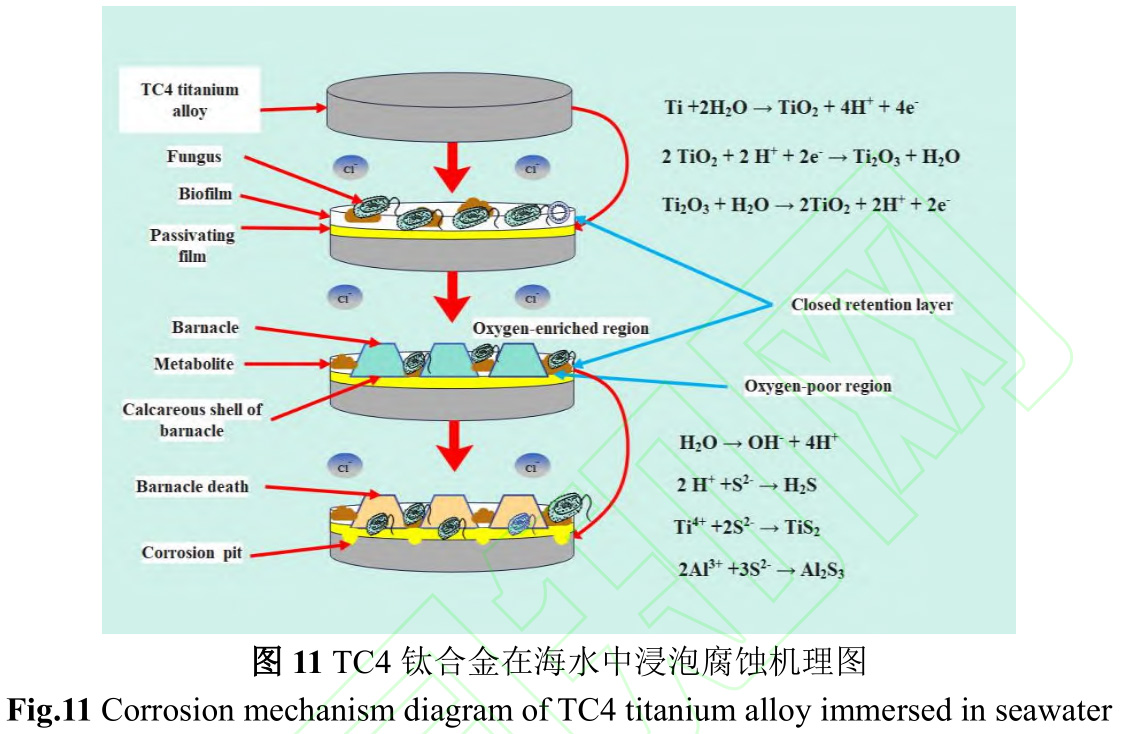
但由于大型污损生物不均匀附着以及存在耗氧和产氧生物,易造成不同区域氧浓度差异,形成氧浓差电池,富氧区作为阴极接受电子发生还原反应(反应4),贫氧区作为阳极失去电子发生氧化反应(反应5),由表1可知TC4钛合金主要成分为Ti和Al,那么阳极发生是主要反应如反应6、7所示,形成局部腐蚀(反应8、9),表现为如图5所示的溃疡坑或较为密集点蚀。
O2+2H2O+4e−→4OH−(4)
M→M+++2e−(5)
Ti−2e−→Ti2+(6)
Al−3e−→Al3+(7)
Al3++3Cl−→AlCl3(8)
4AlCl3+3O2→2Al2O3+6Cl2(9)
Sangeetha等[44]认为藤壶胶能够破坏钝化膜,为海水中的Cl−等卤素腐蚀性离子提供了通道,从而导致腐蚀不断发展。而Eashwar等[45]认为藤壶死亡是材料发生局部腐蚀的先决条件。图1中第30d开始发现有藤壶死亡,结合图5的3D微观图局部腐蚀情况可知与Eashwar等的研究更相符。藤壶死亡后,藤壶有机体被好氧细菌分解产生酸性物质,降低藤壶壳内溶液pH,而酸性物质沿着藤壶壳基底中心向试样表面渗透,最后发生局部腐蚀。
3、结论
1.钛合金在海水中的腐蚀规律受污损生物演替规律影响。不同生长阶段的藤壶对TC4钛合金的腐蚀机制有所不同,结构完整的活体藤壶钙质外壳和致密藤壶胶能够有效隔离外界
腐蚀介质,死亡藤壶则因壳体结构不完整与有机体分解,促进腐蚀发生。
2.污损生物附着改变海水中的溶解氧向钛合金表面传输效率,从而影响钝化膜的形成与再生,同时造成钛合金表面介质性质不均匀化,促成局部腐蚀发生。
3.藤壶等污损生物不均匀附着形成“封闭滞留层”,导致出现富氧区和贫氧区,构成氧浓差电池。富氧区作为阴极接受电子发生还原反应,贫氧区作为阳极失去电子发生氧化反应,促进局部腐蚀。TC4钛合金在海水、钝化膜和污损生物附着协同作用下,腐蚀速度非线性波动变化。
参考文献
[1] 王海杰, 王佳, 彭欣等. 钛合金在 3.5%NaCl 溶液中的腐蚀行为[J].中国腐蚀与防护学报,2015, 35(1): 75-80.
WANG H J, WANG J, PENG X, et al. Corrosion Behavior of Three Titanium Alloys in 3.5%NaCl Solution[J]. Journal of Chinese Society for Corrosion and Protection, 2015, 35(1):75-80.
[2] 訾群.钛合金研究新进展及应用现状[J].钛工业进展, 2008, 25(2): 23-27.
ZI Q. New Development of Titanium Alloy and Its Application Actuality[J]. Titanium Industry Progress, 2008, 25(2): 23-27.
[3] GORYNIN I V. Titanium Alloys for Marine Application[J]. Materials Science and Engineering, 1999, 263(2), 112-116.
[4] WAKE H, TAKAHASHI H, TAKIMOTO T, et al. Development of An Electrochemical Antifouling System for Seawater Cooling Pipelines of Power Plants Using Titanium[J].Biotechnology and Bioengineering, 2006, 95(3), 468-473.
[5] 王广夫.舰船海水管路系统防腐防污技术进展[J].材料开发与应用, 2016, 31(4): 108-112.
WANG G F. Development of Anti-corrosion and Fouling of Seawater Pipe System of Marine Ship[J]. Development and Application of Materials, 2016, 31(4): 108-112.
[6] LAQUE F L. Topics for Research in Marine Corrosion[J]. Materials Performance, 1982, 21,13-18.
[7] MARTIN W. Marine Epibiosis 1. Fouling and Antifouling - Some Basic Aspects[J]. Marine Ecology Progress Series, 1989, 58: 175-189.
[8] VINAGRE P A, SIMAS T, CRUZ E, et al. Marine Biofouling: A European Database for the Marine Renewable Energy Sector[J]. Journal of Marine Science and Engineering, 2020, 8(7):495-522.
[9] XU D K, ZHOU E Z, ZHAO Y, et al. Enhanced Resistance of 2205 Cu-bearing Duplex Stainless Steel Towards Microbiologically Influenced Corrosion by Marine Aerobic Pseudomonas Aeruginosa Biofilms[J]. Journal of Materials Science & Technology, 2018, 34,1325-1336.
[10] MACHUCA L L, BAILEY S I, GUBNER R, et al. Effect of Oxygen and Biofilms on Crevice Corrosion of UNS S31803 and UNS N08825 in Natural Seawater[J]. Corrosion Science,2013, 67, 242-255.
[11] MACHUCA L L, JEFFREY R, BAILEY S I, et al. Filtration-UV Irradiation as an Option for Mitigating the Risk of Microbiologically Influenced Corrosion of Subsea Construction Alloys in Seawater[J]. Corrosion Science, 2014, 79, 89-99.
[12] XU D K, LI Y C, GU T Y. Mechanistic Modeling of Bio-corrosion Caused by Biofilms of Sulfate Reducing Bacteria and Acid Producing Bacteria[J]. Bioelectrochemistry, 2016, 110,52-58.
[13] LI H B, ZHOU E Z, REN Y B, et al. Investigation of Microbiologically Influenced Corrosion of High Nitrogen Nickel-free Stainless Steel by Pseudomonas Aeruginosa[J].Corrosion Science, 2016, 111, 811-821.
[14] AL-MUHANNA K, HABIB K. Marine Biofouling of Different Alloys Exposed to Continuous Flowing Fresh Seawater by Electrochemical Impedance Spectroscopy[J]. Journal of Saudi Chemical Society, 2016, 20(4): 391-396.
[15] LI Z, WANG J, DONG Y Z, et al. Synergistic Effect of Chloride Ion and Shewanella Algae Accelerates the Corrosion of Ti-6Al-4V Alloy[J]. Journal of Materials Science & Technology,2021, 71, 177-185.
[16] 钱鸿昌.高盐环境典型钢铁材料嗜盐古菌微生物腐蚀行为机理研究[D].北京:北京科技大学, 2019.
QIAN H C. Study on Microbiologically Influenced Corrosion Behavior and Mechanism of Typical Steel and Iron Materials by Halophilic Archaea in High Salinity Environment[D].Beijing: University of Science and Technology Beijing, 2019.
[17] BAUTISTA B E T, WIKIEL A J, DATENKO I, et al. Influence of Extracellular Polymeric Substances (EPS) from Pseudomonas NCIMB 2021 on the Corrosion Behavior of 70Cu-30NiAlloy in Seawater[J]. Journal of Electroanalytical Chemistry, 2015, 737, 184-197.
[18] DUAN J Z, WU S R, ZHANG X J, et al. Corrosion of Carbon Steel Influenced by Anaerobic Biofilm in Natural Seawater[J], Electrochimica Acta, 2008, 54, 22-28.
[19] HAMZAH E, HUSSAIN M Z, Ibrahim Z, et al. Influence of Pseudomonas Aeruginosa Bacteria on Corrosion Resistance of 304 Stainless Steel[J]. Corrosion Engineering Science Technology, 2013, 48, 116-120.
[20] LI S L, QU Q, LI L, et al. Bacillus Cereus S-EPS as a Dual Bio-functional Corrosion and Scale Inhibitor in Artificial Seawater[J]. Water Research, 2019, 166, 1-11.
[21] Liu T, GUO Z W, ZENG Z S, et al. Marine Bacteria Provide Lasting Anticorrosion Activity for Steel Via Biofilm-induced Mineralization[J]. ACS Applied Materials Interfaces, 2018, 10,40317-40327.
[22] 马士德,郭为民,刘欣,等.工业纯钛(TA2)在南海三亚海洋环境试验站海水全浸的生物污损与腐蚀[J]. 海洋科学, 2018, 42(10): 23-30.
MA S D, GUO W M, LIU X, et al. Biofouling and Corrosion Analyses of Industrial Pure Titanium (TA2) Immersed in Seawater at Sanya Marine Environmental Test Station in South China Sea[J]. Marine Sciences, 2018, 42(10): 23-30.
[23] BLACKWOOD D J, LIM C S, TEO S L M, et al. Macrofouling Induced Localized Corrosion of Stainless Steel in Singapore Seawater[J]. Corrosion Science, 2017, 129, 152-160.
[24] DE BRITO L V R, COUTINHO R, CAVALCANTI E H, et al. The Influence of Macrofouling on the Corrosion Behavior of API 5L X65 Carbon Steel[J]. Biofouling, 2007, 193-201.
[25] BLACKWOOD D J, LIM C S, TEO S L M. Influence of Fouling on the Efficiency of Sacrificial Anodes in Providing Cathodic Protection in Southeast Asian Tropical Seawater[J].Biofouling, 2010, 26, 779-785.
[26] NEVILLE A, HODGKIESS T. Localised Effects of Macrofouling Species on Electrochemical Corrosion of Corrosion Resistant Alloys [J]. British Corrosion Journal, 2013,35, 54-59.
[27] NEVILLE A, HODGKIESS T. Comparative Study of Stainless Steel and Related Alloy Corrosion in Natural Sea Water[J]. British Corrosion Journal, 1988, 33(2), 111-120.
[28] DEXTER S C. Biofouling and Biocorrosion[J]. Bulletin of Electrochemistry, 1996, 12, 1-7.
[29] 严涛,张慧,李韵秋,等.污损性管栖多毛类生态特点及研究展望[J]. 生态学报, 2014, 34(21):6049-6057.
YAN T, ZHANG H, LI Y Q, et al. An Overview of Fouling Sedentary Polychaetes[J]. Acta Ecologica Sinica, 2014, 34(21): 6049-6057.
[30] 李争显,王浩楠,赵文.钛合金表面海生物污损及防护技术的研究现状和发展趋势[J].钛工业进展, 2015, 32(6): 1-7.
LI Z X, WANG H N, ZHAO W. Current Research Situation and Development Trend of the Biofouling and Antifouling Technology on Titanium Alloy[J]. Titanium Industry Progress, 2015, 32(6): 1-7.
[31] RAMAN S, KUMAR R. Interfacial Morphology and Nanomechanics of Cement of the Barnacle, Amphibalanus Reticulatus on Metallic and Non-metallic Substrata[J]. Biofouling,2011, 27(6): 569-577.
[32] LI C, WANG G, CHEN K Y, et al. Mechanical Analysis of A Scraping Method to Remove Attached Barnacles[J]. Journal of Marine Science and Engineering, 2020, 8(3): 150-164.
[33] CRISP D J, BOURGET E. Growth in Barnacles[J]. Advance in Marine Biology, 1985, 22:199-244.
[34] 铁镝,刘贵昌,刘晓军,等.环境温度对东方小藤壶(Chthamalus challengeri)生命表征的影[J].海洋环境科学, 2010, 29(2): 191-195.
TIE D, LIU G C, LIU X J, et al. Influence of Environmental Temperature on Vital Status of Barnacle: Chthamalus Challengeri[J]. Marine Environmental Science, 2010, 29(2): 191-195.
[35] SOUTHWARD A J. On the Behavior of Barnacles III. Further Observations on the Influence of Temperature and Age on Cirral Activity [J]. Journal of the Marine Biological Association of the United Kingdom, 1957, 36(2): 323-334.
[36] 李友炽,王贵,吴敬权,等.海洋污损生物藤壶生长过程及附着强度研究[J].海洋科学, 2023,47(8): 60-67.
LI Y C, WANG G, WU J Q, et al. Study on the Growth Process and Attachment Strength of Marine Fouling Barnacles[J]. Marine Sciences, 2023, 47(8): 60-67.
[37] WENDT D E, KOWALKE G L, KIM J, et al. Factors that Influence Elastomeric Coating Performance: the Effect of Coating Thickness on Basal Plate Morphology, Growth and Critical Removal Stress of the Barnacle Balanus Amphitrite[J]. Biofouling, 2006, 22(1): 1-9.
[38] 马士德,谢肖勃,黄修明,等.藤壶附着对海水中金属腐蚀的影响[J].中国腐蚀与防护学报,1995, 15(1): 74-78.
MA S D, XIE X B, HUANG X M, et al. The Effect of Barnacle Adhesion on Metal Corrosion in Seawater[J]. Journal of Chinese Society for Corrosion and Protection, 1995, 15(1): 74-78.
[39] ZHENG X W, ZHUANG X, LEI Y H, et al. Corrosion Behavior of the Ti-6Al-4V Alloy in Sulfate-Reducing Bacteria Solution[J]. Coatings, 2019, 10(1), 24.
[40] DENG P C, SHANGGUAN J Y, HU J Z, et al. Effect of Barnacles on the Corrosion Behavior of 304 Stainless Steel[J]. Metals, 2023, 13, 1649-1658.
[41] VENKATESAN R, MURTHY P S. Macro-fouling Control in Power Plants[M]. Berlin, Heidelberg: Springer, 2008.
[42] LEWIS J A. Marine Biofouling and Its Prevention on Underwater Surfaces[J]. Materials Forum, 1998, 22: 41-61.
[43] 马士德. 金属/海水界面两个主要过程的关系[J].海洋湖沼通报, 1979, 02: 85-89.
MA S D. The Relationship of Two Main Process on Metal/Sea Water[J]. Transactions of Oceanology and Limnology, 1979, 02: 85-89.
[44] SANGEETHA R, KUMAR R, DOBLE M, et al. Barnacle Cement: An Etchant for Stainless Steel 316L[J]. Colloids and Surfaces B: Biointerfaces, 2010, 79(2), 524-530.
[45] EASHWAR M, SUBRAMANIAN G, CHANDRASEKARAN P, et al. Mechanism for Barnacle-Induced Crevice Corrosion in Stainless Steel[J]. Corrosion, 1992, 48(7), 608-612.
相关链接