引言
随着大规模集成电路和半导体芯片制造技术的飞速发展,集成电路单位面积上可容纳的晶体管数量成倍增加,芯片制程不断缩小。在电路变得更窄的同时,电流密度将更大,半导体芯片中金属材料的纯度和稳定性成为影响芯片质量和使用寿命的重要因素。
高纯金(Au)具有电阻低、电迁移低、热稳定性高、抗氧化和耐腐蚀能力强等诸多优点,能与半导体形成欧姆接触,并能良好地附着于硅基体,因此被大量应用于半导体芯片领域的金属化系统。此外高纯金还用于集成电路和芯片的先进封装、键合以及焊接材料等。高纯金在集成电路和芯片制造领域的主要应用形式是高纯金溅射靶材。利用真空磁控溅射技术将高纯金镀覆于基体表面,再在镀覆的金膜上进行刻蚀,即可形成集成电路及芯片中的微细连接[12-14]。
高纯金的制备过程实质是粗Au精炼提纯的过程,粗Au的精炼方法分为火法和湿法。火法过程工艺控制不稳定,产品纯度不高,主要用于高纯金制备的前处理过程,而湿法产品质量稳定,可制备出纯度大于5N(99.999%)的高纯金[19-20]。Au的湿法精炼有直接还原法、溶剂萃取-还原法和电解法,3种方法各有其优缺点及技术难点21-23。本文综述了国内外对高纯金及金靶材制备工艺的研究进展,分析了高纯金及金靶材制备过程的难点及各方法的优缺点,并对高纯金及金靶材的未来发展进行了展望。
1、高纯金及金靶材技术要求
1.1高纯金技术要求
高纯金纯度以质量分数表示。国标GB/T259332010中规定高纯金质量分数应不小于99.999%,杂质质量分数总和应不大于10x10-6,其中杂质包括Ag,Cu,Fe,Pb和Bi等21种元素,当杂质元素实测质量分数低于0.2x10-6时可不参与差减24。表1为GB/T25933-2010中所规定的常规高纯金杂质控制标准。然而,半导体行业用高纯金的标准更为严苛,不仅要求全部金属元素杂质总和不大于10x10-6,而且特别要求碱金属元素K,Na和Li等杂质含量要低于0.1x10-6,非金属杂质元素C,H,O,N和S等总含量应小于100x10-6,单一非金属杂质含量低于50x10-6[25]
表1 GB/T25933-2010高纯金杂质含量标准
| 元素 | Ag | Cu | Fe | Pb | Bi | Sb | Si | Pd | Mg | As | Sn | Cr | Ni | Mn | Cd | Al | Pt | Rh | Ir | Ti | Zn |
| 质量分数 | 2 | 1 | 2 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2 | 1 |
1.2高纯金靶材技术要求
高纯金靶材包括纯金靶和金基合金靶材。金基合金是以高纯金为基体,添加其他合金元素形成的多元金基合金功能材料。由于其他高熔点金属的加入,金基合金的再结晶温度会大幅度提高,物理性能也会发生改变,但仍保留Au原有的抗氧化、耐腐蚀等优异理化性质26。将高纯金及其合金制成靶材,利用真空磁控溅射技术将其镀覆于其他基体部件表面,被镀覆的部件即可提高耐高温、抗氧化以及防腐蚀性能[27]
靶材的设计取决于靶材溅射设备阴极磁场的结构,靶材的形状必须与所用溅射设备匹配[28]。常见的高纯金靶材的形状有圆形、矩形和异形,此外还有空心和实心等不同类型的靶材[29]。
半导体用高纯金属溅射靶材纯度要求较高。靶材纯度越高,薄膜性能越好。通常溅射靶材中的杂质会导致溅射时的不正常放电,同时在靶材内部形成夹杂物,在溅射的晶圆上形成微粒,造成金属互连线的短路或断路,严重影响薄膜材料性能[30]。金靶材中杂质及其主要危害包括:碱金属元素(如Li,Na,K等)易在绝缘层产生电迁移,降低绝缘层的绝缘性能;放射性元素(如U,Th等)则会释放射线击穿半导体器件;过渡金属元素(如Fe,Ni,Cr等)会导致界面漏电和薄膜中氧含量增加[31];气体元素(如O,N等)不利于薄膜的稳定,会导致薄膜材料电阻增大。因此靶材中这类杂质含量应被严格控制。
高纯金靶材除纯度外,还对靶材的微观组织形貌、晶体粒度、组织均匀性等有着更高的要求。在微观组织方面,靶材晶粒尺寸和取向等对薄膜材料的沉积率和均匀性有很大的影响。晶粒细小的靶材溅射速度更快,晶粒均匀的靶材溅射沉积的薄膜厚度更加均匀,即晶粒越细小均匀,溅射薄膜质量越高。靶材对于表面粗糙度、外观和内部质量也有要求,一般要求表面粗糙度R值不大于1.6μm,靶材表面无凹坑、划伤、裂纹、凸起等缺陷,内部不应有分层、疏松、夹杂、气孔等。
高纯金靶材通常要求平均晶粒尺寸小于200μm,随着对溅射薄膜的要求愈来愈高,目前更多高纯金靶材要求平均晶粒尺寸小于100μm,甚至更小,同时要求晶粒无明显取向[34]。
2、高纯金的制备
高纯金的制备过程主要是利用物理化学手段对粗Au进行精炼,深度去除粗Au中的杂质,进而得到高纯度的Au。Au的精炼按工艺可分为火法精炼和湿法精炼。
2.1金的火法精炼
Au的火法精炼包括氧化精炼和氯化精炼。
Au的氧化精炼是将粗Au和氧化剂、造渣剂一起进行熔炼,在高温(1200~1350℃)下将粗Au中的杂质(Zn,Fe,Sn,As,Sb,Pb和Cu等)氧化造渣除去,最终得到较高纯度的Au。
Au的氯化精炼是在粗Au熔炼过程中通入氯气,使其中的杂质元素发生氯化反应生成相应的氯化物,沸点较低的氯化物会挥发除去(如FeCl3和ZnCl2),沸点较高的氯化物则会漂浮于熔体表面(如PbCl2,CuCl2和AgCl),待熔体表面的渣和漂浮物聚集到一定量时进行清除,最终将Au和杂质分离得到纯度更高的Au。
Au的火法精炼由于反应温度较高,过程可控性较差,粗Au中的杂质去除不完全,精炼后的Au纯度最高仅能达到99.9%,且精炼过程中Au会夹杂在渣中或随挥发物进入烟尘,造成Au的损失。但火法精炼处理粗Au单批次处理量大,可作为高纯金制备的前端工艺。
2.2金的湿法精炼
Au的湿法精炼主要在氯化溶液体系中进行,采用湿法冶金中的溶液净化和还原等方法对Au溶液进行深度净化除杂和还原,进而得到高纯金[36]。 Au的湿法精炼主要有直接化学还原法、萃取-还原法和电解法。与火法过程相比,Au的湿法精炼过程更加可控,产品质量更加稳定,纯度也更高,可以制备出纯度99.999%的高纯金。因此,高纯金的制备通常采用湿法[37]。
2.2.1直接化学还原法
直接化学还原法制备高纯金主要包括溶解造液和选择性还原两个过程。首先将粗Au溶解于氯化溶液体系中,再通过还原剂的还原作用选择性地将溶液中Au3+还原为单质Au析出。通过控制电位,可在还原过程中使杂质不被还原,仍以离子形式存在于溶液中,实现杂质与Au的分离。直接化学还原法制备高纯金工艺流程如图1所示。
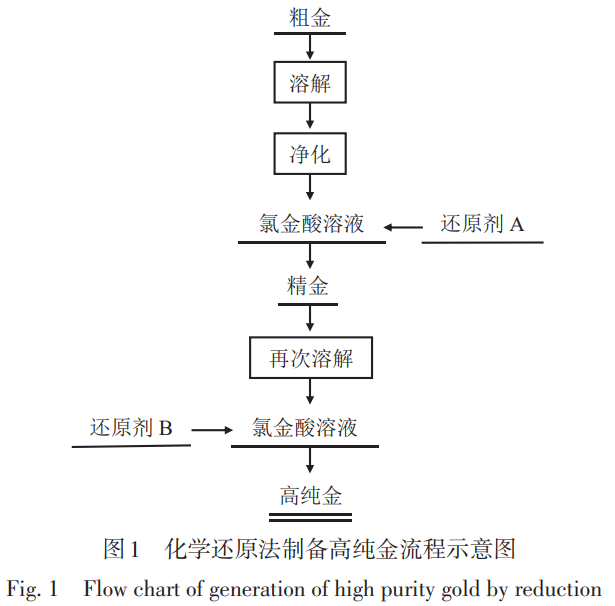
Au在溶解-还原过程中与杂质分离的原理是:利用Au和其他金属标准电极电势的差异,通过控制溶液的氧化还原电位实现Au的深度净化。部分金属标准电极电势(Eθ)见表2[38]。可以看出:Au3+/Au的标准电极电势很高(1.50V),导致Au3+可以轻易被还原剂还原为Au单质,而贱金属杂质(Cu, Fe,Zn, Pb, Sn和Mn等)离子吸收电子转变为单质的标准电极电势普遍较低(为负值),不易被还原。因此,在还原过程中控制溶液的氧化还原电位在一定值(700~800mV),就能从溶液中选择性还原Au。
Au的标准电极电势高也意味着Au难以溶解进入溶液。Au具备极高的化学稳定性和耐腐蚀性,
表2部分金属标准电极电势
| Electrode reaction | Eθ/ V |
| Mg2+(aq)+2 e--> Mg(s) | -2.36 |
| Al3+(aq)+3 e--> Al(s) | -1.68 |
| Mn2+(aq)+2 e--> Mn(s) | -1.18 |
| Zn2+(aq)+2 e--> Zn(s) | -0.76 |
| Cr3+(aq)+3 e--> Cr(s) | -0.74 |
| Fe2+(aq)+2 e--> Fe(s) | -0.41 |
| Cd2+(aq)+2 e--> Cd(s) | -0.40 |
| Ni2+(aq)+e--> Ni(s) | -0.24 |
| Sn2+(aq)+2 e--> Sn(s) | -0.14 |
| Pb2+(aq)+2 e--> Pb(s) | -0.13 |
| Cu2+(aq)+2 e--> Cu(s) | 0.34 |
| Ag^{+}(aq)+e--> Ag(s) | 0.80 |
| Au3+(aq)+3 e--> Au(s) | 1.50 |
因此单一的酸不能溶解Au,只有王水或者酸中有强氧化剂存在时才能溶解Au,使其以Au3+的形式进入溶液。
王水溶金的原理是王水溶液中的HCl被HNO3氧化生成NOCl(氯化亚硝酰)和Cl2,这种新生态的NOCl和Cl2都具有极强的氧化性,足以将Au氧化成Au3+进入溶液[39]。 Au3+在溶液中有大量Cl存在时会与其生成稳定的平面正方形结构的配离子[AuCl4]-,这一过程会显著降低Au溶解所需的氧化还原电势,使Au溶解过程电势由原来Au3+/Au的1.50V变为[AuCl4]/Au的0.99V,极大地促进了Au的溶解,王水溶金过程的反应方程式如式(1~6)所示:
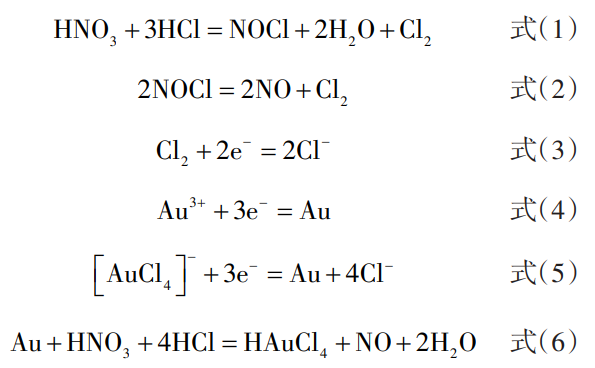
王水溶金法是黄金湿法精炼中常用的造液方法,具有工艺简单、溶金效率高等优点,但在处理含银量高的原料时会生成AgCl沉淀包裹Au,使Au不能完全溶解。王水溶金过程还会产生大量有毒氮氧化物,导致操作环境差,且溶金完成后必须清除溶液中残留的硝酸,否则后续还原金粉时会造成金粉返溶,降低Au的直收率。工业上将清除残余硝酸的步骤称为赶硝,赶硝的方法包括盐酸赶硝、硫酸赶硝、乙醇赶硝、甲醛赶硝、甲酸赶硝、双氧水赶硝、尿素赶硝等,综合考虑成本及环保等问题,工业上多采用盐酸或尿素作为赶硝剂[39]。
由式(1)~(6)可知,王水能溶解Au不仅仅是因其具有极强的氧化性,溶液中大量Cl也起了关键性的作用,根据这种机理,直接向HCl溶液中通入Cl2(水溶液氯化法)或者加入NaClO3(氯酸钠-盐酸法)也可以使Au溶解。赵俊蔚等[40]对王水溶金法和氯酸钠-盐酸法进行了对比实验研究,发现二者Au浸出率相当,且后续制备的海绵金纯度都在99.9%以上,Au的直收率也都大于99%。但氯酸钠-盐酸法相比王水溶金法成本低20%,过程无需蒸发、赶硝等操作,流程更短,且氯酸钠为固体,方便运输储存,安全隐患相对更少。因此,工业上多采用氯酸钠-盐酸法或水溶液氯化法制备Au溶液,王水溶金法则多用于实验室或小型生产企业。
Au溶解后需要控制氧化还原电位将其还原为单质Au。还原Au3的方法较多,如传统的金属置换法,采用铁粉、铜粉、锌粉等都能迅速地将溶液中的Au3+还原,且经济高效、操作简单、流程短,但此法会引入贱金属杂质,污染产品,降低Au的纯度,因此一般用于对纯度要求不高的提纯过程或Au的回收。
制备高纯金所用还原剂不仅要求具备良好的选择性和还原效果,而且不能引入新的杂质。常用还原剂有亚硫酸钠或亚硫酸氢钠、二氧化硫、草酸等。其中二氧化硫为气体,相比于其他固/液体还原剂更纯净,引入杂质更少,还原后的Au纯度更高,但其还原效果不及亚硫酸钠等固体还原剂。此外,一些还原性强的有机化合物,如抗坏血酸等也可用于Au的还原,由于其制备过程为生物发酵,不涉及其他无机金属盐,因此不会引入新的金属杂质。抗坏血酸目前主要用于还原制备微细粒度的Au,也可用于高纯金的制备。
通常Au在选择性还原后呈海绵状或砂状,经洗涤、熔炼后纯度可达99.999%。Zhang等[41]研究了亚硫酸钠还原氯金酸溶液过程溶液电位、Au离子浓度及Au还原率之间的关系,结果表明还原过程分为两个阶段:第一阶段为快速还原阶段,当溶液电位降低至760mV时溶液中Au离子浓度随还原过程的进行迅速下降;第二阶段为慢还原阶段,此阶段溶液中Au离子浓度较低,还原过程缓慢,最终当溶液电位降低至550mV以下时,溶液中的Au离子浓度可降低至5mg/L以下,Au的还原率可达99.7%,但同时部分杂质也会被还原,降低Au的纯度。郭晓亮等[42]以氰化金泥中回收的粗金粉(纯度为91%~98%)为原料,采用氯酸钠-盐酸法溶金,金液经过加水稀释、冷却除杂后用焦亚硫酸钠还原,控制电位在690~700mV,还原率约为85%,残留Au二次还原后得到黑金粉进入下一批次溶解,产品经洗涤、硝酸浸煮除杂后铸锭,最终能够稳定生产出国家标准金锭GB/T4134-2014[43]中的IC-Au99.99级产品。庄宇凯等[44]以纯度大于99.9%的金锭为原料,采用水溶液氯化法溶金,焦亚硫酸钠为还原剂,溶液氧化还原电位控制为690~700mV,经过两次溶解-还原过程,制备出满足国标GB/T25933-2010的5N(99.999%)级高纯金。李光胜等[45]用王水法溶金,分别以质量分数约为91.8%,95.9%和99.8%的3种粗Au为原料,通过控制还原剂加入量使溶液氧化还原电位控制在690~720mV,经过二次王水-二次还原后分别得到纯度为99.9995%,99.9997%和99.9998%的高纯金。赵家春等[46]以纯度99.95%的金锭为原料,采用王水法溶金,使用NaOH调节溶液pH,将溶液中的贱金属杂质以氢氧化物的形式沉淀除去,并在还原之前严格控制过滤条件,避免溶液中的微细沉淀粒子穿滤造成污染,过滤后的溶液经稀释并用NaOH调节pH后还原,最终金粉洗涤后纯度可达99.999%,且用此金粉熔炼加工制成的蒸发材料纯度大于99.999%,可用作制造集成电路芯片的蒸发材料。
直接还原法制备高纯金工艺简单、效率高、周期短、对原料适应性强,局限在于产品质量不稳定,若要一次性制备出99.999%的高纯金,需要纯度较高的原料,并对溶液进行精密除杂,但常规的除杂手段如水解沉淀法、中和沉淀法等对杂质的脱除率有限,且容易引入新的杂质。因此在原料杂质含量较多时,通常需要重复2~3次除杂过程才能制得合格产品。同时还原剂的选择也至关重要,众多研究报道对于还原出纯度大于99.999%的Au,其还原剂的选择多为保密内容。
2.2.2溶剂萃取-还原法
溶剂萃取-还原法制备高纯金是利用Au3+可与多种有机萃取剂形成稳定配合物而溶于有机试剂的性质,生成载金有机相并与水相分离,达到Au富集和提纯的目的。载金有机相经反萃后还原或用还原剂直接还原可制备出高纯金。萃取-还原法制备高纯金工艺流程图如图2所示。可从酸性介质、氯化物体系中萃取Au3+的萃取剂有很多,按种类可分为含氧萃取剂、含磷萃取剂、含硫萃取剂、含氮萃取剂等,其中含氧萃取剂在Au3+的萃取中应用较多,主要包括醇类、醚类、酮类、酯类等萃取剂[47]。
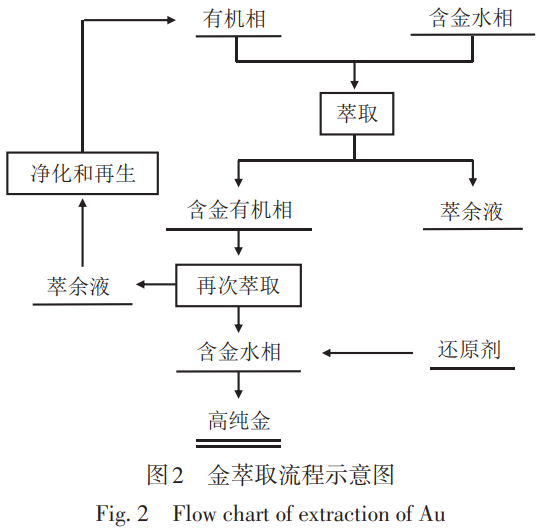
含氧萃取剂对Au3+的萃取是基于离子缔合机理,即在酸性条件下,萃取剂能和H+作用生成烊阳离子,然后与Au的配阴离子[AuCl4]-作用生成中性的离子缔合物,被萃人有机相中。含氧萃取剂中应用较广的有乙醚、二丁基卡必醇(DBC)、甲基异丁基酮(MIBK)等。以乙醚为例,其萃取过程如式(7)和(8)所示:
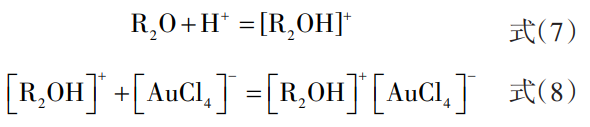
其中R为疏水烃基(C2 H5),[R2 OH]+[AuCl4]-为生成的烊盐。根据相似性原理,烊盐可溶于过量的乙醚从而进入有机相与杂质分离,此过程即为生成烊盐的萃取过程。王芳举以纯度大于99.9%的粗Au为原料,采用电解造液法制备氯金酸溶液,乙醚为萃取剂,油相/水相(O/A)比为1:1,对氯金酸溶液进行二次萃取-二次反萃,最终用二氧化硫还原水相得到99.999%的高纯金。但乙醚具有沸点低,挥发性极大且能致人麻醉的特点,已被禁止使用。
二丁基卡必醇(DBC)分子式为C12 H26 O3,是一种缩醚,其具有在水中溶解度小、挥发性小、闪点高(约113℃)、合成简单、对Au3+选择性良好等诸多优点,被大规模用于Au3+萃取[50]。刘日辉等[51]对DBC萃取Au3+的性能进行了实验研究,发现最佳萃取条件为酸度1~2mol/L、O/A=1:1、萃取时间10min,最高萃取率可达99.9%。刘日辉等还考察了不同稀释剂和协同萃取剂对萃取率的影响,发现以二甲苯和磺化煤油作为稀释剂,异戊醇和甲基异丁基酮(MIBK)为协萃剂都能取得很好的效果,萃取率都在99%以上。刘谟禧等[52-55]以及孙树森[56]对DBC萃取Au3+的机理和工程应用进行了大量研究,并用于金川公司工业生产,表明了DBC萃取Au3+具有良好的萃取效果和稳定性。孙根荣[57]以纯度99%以上的金泥和合质金作为原料,采用王水分金法制备Au溶液,用DBC为萃取剂进行5级逆流萃取,载金有机相经稀盐酸溶液3级洗涤后用亚硫酸钠溶液还原反萃,成功制备出纯度大于99.999%的高纯金。吴卫煌[58]针对DBC萃取制备高纯金生产过程效率低、作业环境差等问题,提出引入CTL150-N型离心机强化萃取传质过程,提高自动化水平,改善现场作业环境,同时提高Au的直收率和合格率。
DBC对[AuCl4]-的结合力强是其萃取效果好的根本原因,但强的结合力会导致后续Au的反萃困难,需要用热草酸(80~85℃)或亚硫酸钠溶液反萃才能取得很好的反萃效果[50,59]。 Jung等[20]对DBC反萃工艺进行了改进,将负载有机相直接与浓氨水接触,生成固体中间产物雷金(Au2 O3·3 NH3),雷金后续用水合肼还原为金粉,制备出99.9998%的高纯金。
除DBC萃取剂外,一些新的萃取剂也在不断地被用于Au的萃取。 Oshima等[60]介绍了一种市售的新型醚化溶剂环戊基甲醚(CPME),可用于萃取酸性介质中的Au3+,CPME对Au3+的负载量高达60g/L,且在较高酸度条件下对Au的萃取率可达98%,虽略低于DBC的萃取率,但反萃率更高。 Horiuch等[59]研制了一种芳香醚类化合物o-MOB,其对Au3+的萃取率高于DBC,且有较好的选择性。还有研究表明,脂肪酮类化合物如2-壬酮等对Au也有良好的萃取性能,这些酮类化合物与商用萃取剂相比,具有更好的物理性能,如更低的水溶解度、黏度以及更高的闪点等[60]。
溶剂萃取-还原法制备高纯金质量稳定、纯度高、工艺成熟,但有机试剂易挥发、消耗大、污染大,且易燃易爆,并且Au的反萃困难也会造成Au的损失。
近年来,一类对环境无毒、无害、无污染的“绿色溶剂”被大量研究用于萃取金属。离子液体(ionic liquids, ILs)是一种完全由离子组成的有机溶液,可由不同的阴阳离子任意组合,具有良好的可设计性。相比于传统有机萃取剂,ILs具有熔点低、沸程宽(0~400℃)、蒸气压低、溶解性好、非可燃性等优势[61]。长期以来ILs在液液萃取中的应用研究一直受到广泛关注。Boudesocque等[62]介绍了由四己基铵、四辛基铵为阳离子,Br-、双氰胺(Dca-)、SCN-、双三氟甲磺酰亚胺(TF2 N-)为阴离子组合的几种离子液体,研究了它们对Au3+, Pt2+和Pt4+萃取性能,结果显示上述所有的离子液体体系都对Au3+有着良好的萃取性。苏红梅[63]合成了两种双子型苯并咪唑类型离子液体[C4-6-C4 BIm]Br2和[C4-6-C4 BIm][Tf2 N]2,并对其萃取Au3+的性能及机理进行了研究,结果表明两种离子液体对Au3+的萃取性都极高,且[C4-6-C4 BIm][Tf2 N]2具有良好的稳定性和疏水性。离子液体相比于传统有机萃取剂,更加绿色环保,随着研究的深入,其在液-液萃取的潜力不断被发掘,具有广阔的应用前景。
2.2.3电解法
电解法制备高纯金以粗Au作为阳极,纯Au或惰性金属作为阴极,Au的氯配合物溶液和盐酸作为电解液,利用Au标准电极电势高,在电解时会优先在阴极析出这一原理实现Au的提纯和还原。金电解过程如图3所示。
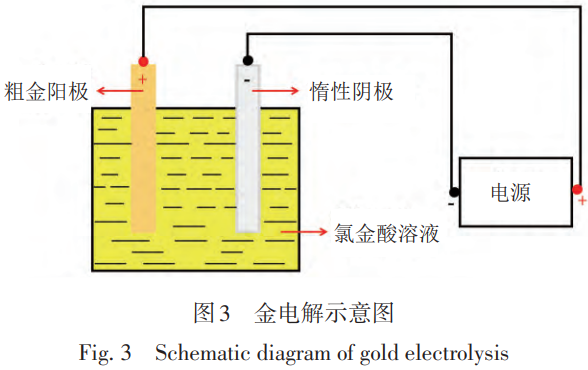
电解过程中,在直流电的作用下,阳极失去电子,粗Au中的Au和大部分杂质金属(Cu,Pb,Bi,Fe和Te等)会被氧化为金属阳离子溶解进入溶液,比Au标准电极电势更高的金属杂质(Rh, Ir, Ru和Os等)则留在阳极或进入阳极泥中,以进一步回收利用[64]。
电解过程阳极反应如下:
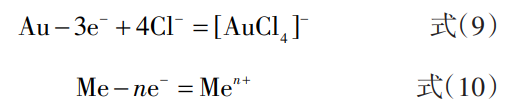
电解过程中阴极得到电子,溶液中Au3+被优先还原为单质Au在阴极板上析出,杂质金属离子在一定电流密度且溶液中存在高浓度Au3+时不会被还原,仍留在电解液中。
阴极反应如下:
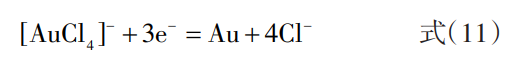
在电解过程中,除Au3+外还会有少量的Au+生成,Au+会发生歧化反应生成金粉沉淀于电解槽底部,其反应如下:
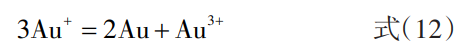
金粉的产生不利于高效生产,将导致Au的直收率降低,因此需要抑制金粉产生。 Schalch等[65]认为电解过程中阳极生成的Au+有两个去处,一部分在阳极表面被氧化为Au3+,而另一部分会逸散到溶液中,歧化生成金粉或在阴极析出。他研究了不同条件下阳极Au的溶解,并测定溶液中的Au+浓度,实验结果表明:提高电流密度、降低电解液温度、降低搅拌转速、降低氯离子浓度等手段可以降低溶液中Au+的浓度。此项研究为Au电解过程参数控制提供了参考,并用于兰德精炼厂99.99%纯度Au的连续生产,减少了电解槽中金粉的数量。此外,部分精炼厂会在电解液中添加硝酸[66]。硝酸的作用主要包括两个方面:一是将Au氧化为Au,从而减少Au+歧化反应产生的金泥;二是溶解电解槽中已产生的金粉并加速阳极粗Au溶解,其原理和王水溶金相同。
正常电解条件下,阳极只发生溶解反应,但当电解液中盐酸浓度和温度较低时,Au阳极会有钝化倾向,开始析出氯气甚至氧气,使电化学溶解过程中断,电解液中Au3得不到补充,影响阴极产品质量39。此外,粗Au中所含的Ag也会造成阳极钝化,Ag在电解过程中会生成不溶AgCl包裹阳极,阻碍Au的溶解。为解决Ag造成的阳极钝化,孙戬等提出在电解时同时通入交流电和直流电形成脉动电流,电流大小呈周期性变化,波峰时阳极的瞬时电流密度大,析出气体破坏AgCl包裹层,消除阳极钝化,波谷时电流为负,抑制AgCl生成。此法在中国株洲冶炼厂[69]、白银公司冶炼厂[70]以及江铜贵溪冶炼厂进行了工业实践,均取得良好效果。除交直流叠加电源外,新的电解电源也不断被开发并用于Au的电解,如非对称交流电源[73]、周期换向电源[74-75]等。不同电源电流波形图如图4所示。Granato等[76]分别用非对称交流电源(AAC)和周期换向电源(PRC)进行Au电解实验研究,研究结果表明:两种电源均能克服阳极钝化,对Ag含量为17.1%的粗Au进行电解精炼,产品纯度达99.99%,两种电源均对消除阳极Au的歧化有积极作用,可以抑制金粉的产生;采用非对称交流电源电解所获产品形貌比周期换向电源更加致密、均匀,但都优于直流电源所获产品。
Au电解过程参数会直接影响阴极产品质量,这些参数包括Au电解液中Au离子浓度和盐酸浓度电流密度、电解温度、极间距等。电解液中Au离子浓度会影响电流效率和生产效率,Au离子浓度高,阴极板上新晶核形成快,生产效率高,但Au离子浓度过高会造成严重的浓差极化,导致阴极板上下产品形貌不均,影响产品质量。盐酸能够增强溶液导电性,抑制阳极钝化,但酸度过高会降低阴极析氢所需过电位,降低电流效率。阴极电流密度会影响阴极Au的沉积,电流密度低时,晶粒生长速度大于新晶核形成速度,得到的产品晶粒粗大,表面平整;提高电流密度,新晶核形成速度随之加快,产品晶粒细小,同时表面粗糙;电流密度如果过高,Au的沉积速度大于扩散速度,在Au离子密度更高的地方更易晶粒形核与生长,因而产生枝晶,影响阴极形貌且有短路风险[77]。电解过程溶液保持一定温度可以加强溶液传质速率,提高电导率,缓解浓差极化,但温度过高会加快电解液蒸发速率。极间距主要影响槽电压,二者是正相关关系,极间距过大则会导致槽电压高,增加电解过程能耗[78]。 Schalch等在Au离子质量浓度为70g/L、盐酸质量浓度为120g/L的条件下探究了不同温度、阴阳极电流密度对阴极形貌的影响,结果表明:在电解温度为20~25℃,阴极和阳极电流密度为400A/m2的条件下,阴极产品3/4部分呈现光滑、平整的形貌;电解液温度为50℃、阴极和阳极电流密度为850A/m2时所得产品表面更加粗糙,且边缘有大量葡萄状结晶;保持阴极电流密度不变,阳极电流密度提高至1600A/m后,所得产品边缘无葡萄状结晶,阴极表面更加规整,原因可能是更高的阳极电流密度使得阳极粗Au溶解速度加快,电解液中的Au离子得到及时补充,这也表示阳极电流密度高对产品形貌控制是有利的。
国内采用电解精炼法制备高纯金的厂家有浙江遂昌金矿有限公司79-80]、江西铜业贵溪冶炼厂[81]、贵研铂业[82]等。孙敬韬等在贵溪冶炼厂电解液中加入硝酸盐增强导电性,降低溶液酸度,并在电解过程中自动添加盐酸和硫酸混合液以控制电解液中Pb和Ag含量,在金离子质量浓度为115g/L、盐酸质量浓度为85g/L、阴极电流密度为245A/m2、温度为48℃的条件下一次电解生产99.999%高纯金。杨国祥等[84]以纯度大于99.9%的Au为原料,在Au离子质量浓度为60~90g/L、盐酸质量浓度为50~60g/L、氯化钠质量浓度为60~80g/L、温度为50~60℃、阴极电流密度为300~400A/m2条件下成功制备出满足半导体工业需求的99.999%高纯金。
除单纯控制电解参数外,一些溶液净化-电解组合工艺也用于高纯金的制备。马贤杰等[85]以4N(99.99%)金为原料制备电解液(Au离子质量浓度为90g/L),并分别采用两种强酸性阳离子交换树脂(001x7型大孔型和001x14.5型凝胶型)对电解液进行净化除杂,之后以4N金作为阳极,在温度为55℃、槽电压为3V的条件下制备出纯度为99.9992%和99.99997%的高纯金。刘俊林等[86]将阳极溶解和电解沉积分为两步进行,先进行隔膜电解造液,之后将电解液过滤后引出,单独进行电解沉积,用此法分别处理含金99.95%的湿法金泥和含金90%的合质金,均可得到99.999%的高纯金,电沉积后电解贫液Au含量小于10mg/L,可用树脂吸附后回收,生产过程全自动控制,安全环保。
电解法是Au精炼的主要方法,国内外诸多大型黄金精炼厂都采用此法精炼黄金。电解法制备高纯金设备简单、成本低,产品质量稳定、纯度高,但对原料纯度要求较严苛,原料纯度越高产品质量越稳定。电解液是电解制备高纯金的关键所在,直接影响阴极产品质量,必须严格控制造液、净化和电解的过程,防止杂质的引入污染电解液。在电解液净化过程中,针对特定的杂质元素,可采用水解沉淀、络合沉淀、离子交换以及溶剂萃取等多种方法结合,多维度脱除杂质,得到高纯电解液,进而电解制备出超高质量的高纯金。此外,高纯金电解过程参数控制相比于常规电解精炼更为精细、生产周期更长,为提高生产效率,Au电解液需重复利用,因此需要一套严格的控制体系对电解液进行维护和净化。
3、高纯金靶材的制备
真空磁控溅射法是物理气相沉积法(PVD)制备薄膜材料的关键技术之一,其制备出的薄膜材料具有致密度高、附着性好等优点,被广泛应用于电子半导体、航空航天和太阳能电池等行业[87]。高纯金属溅射靶材是真空磁控溅射法制备高性能薄膜材料的关键材料,溅射靶材的主要制备方法包括粉末冶金法和熔炼-热机械处理法[88]。
3.1粉末冶金法
粉末冶金法制备高纯金属靶材是将粒径大小均匀的高纯金属粉末充分混合之后进行烧结,使金属粉末在高温、高压下致密结合,最后对烧结完成的胚料进行机械精加工,完成靶材的制备。粉末烧结工艺有热压烧结、热等静压烧结和放电等离子烧结等[89]。
粉末冶金法制备靶材无需将原料金属粉末加热到完全熔化,因此烧结温度远低于金属熔点,可以制备高纯难熔金属靶材(W,Mo和Ru等)和陶瓷靶材,也可制备组分不同的合金靶材,制备出的靶材具有晶粒细小且分布均匀的优点。但由于金属粉末粒度较小,表面能高,容易与氧气反应,且引入杂质难以去除。烧结过程中,金属颗粒逐渐接触形成烧结颈,之后形成相互独立封闭的孔隙,孔隙不断收缩但不会完全消失,致使粉末冶金法制备出的靶材致密度偏低。
3.2熔炼-热机械处理法
熔炼-热机械处理法是将高纯金属原料熔铸之后进行热处理和机械加工的靶材制备方法。高纯金属靶材的前端原材料由于制备方式的不同会有不同的形状,如粉末状、片状、海绵状等,同时会存在组织分布不均、内部气孔、晶体缺陷、气体杂质夹杂等问题。在真空或特定气氛保护下熔炼能够脱除气体及其他易挥发的杂质,消除内部晶体缺陷和应力,获得均匀的组织结构。经过熔炼的高纯金属通常会被铸成规定尺寸的金属锭,这些铸锭的晶粒粗大,需要通过合适的热处理工艺细化晶粒,最后再经过精密机械加工得到合格的靶材。
Au的化学稳定性高、高温下不与空气反应、可塑性强、熔点容易达到,因此高纯金靶材往往采用熔炼-热机械加工的方法制备。由于Au本身具有吸气性,可以吸附自身体积数十倍的氢气或氧气,在熔炼过程中这些气体又会放出,出现类似“沸腾”的现象。随着气体的放出,熔融状态的Au会喷溅。为此,在熔炼过程中需要严格控制温度和压力以避免Au的喷溅,并保证较好的脱气效果。采用熔炼-热机械加工法制备的高纯金靶材,杂质含量少,晶粒均匀且细小(平均小于200μm)。杨晓东等[90]通过保持特定温度梯度使Au中的杂质元素蒸发,提高纯度,纯化后的高纯金通过真空脱气并在氮气保护下进行热处理,最后机械加工得到纯度大于99.999%、平均晶粒尺寸小于100nm高纯金靶材。
4、总结与展望
近年来,在国家政策大力扶持下,中国集成电路和芯片制造技术快速发展,芯片市场占有率逐年升高,全球半导体供应链逐渐向国内转移,高纯金及高纯金靶材的用量不断增加。面对日益庞大的需求,在国内研究机构和生产企业的努力下,中国已能够生产5N高纯金及高纯金靶材,但仍存在诸多问题,如高纯金杂质总量可达5N标准,但往往某种或多种特定杂质元素超标,不能满足半导体芯片行业的要求,对非金属杂质(C,H,O,N和S等)把控不严,产品批次质量不稳定等,这些因素也导致我国高纯金及高纯金靶材在国际竞争中缺乏优势,难以进入下游企业供应链。
目前,按照国标GB/T25933-2010规定生产的高纯金已经不能满足集成电路和半导体芯片行业要求,且单一方法也难以制备出半导体芯片用高纯金及金靶材,应结合各工艺及方法的优势,深度脱除高纯金中杂质,稳定生产出半导体芯片用超高质量高纯金。可以利用化学还原法流程短、效率高的特点,制备Au电解原料;溶剂萃取法深度净化电解液,确保阴极产品的纯度;电解Au再经过高温熔铸,除去气体杂质及易挥发杂质。只有多种提纯、净化方法的联合运用,才能确保特定杂质的深度脱除并实现高纯金纯度稳定达标。此外,须严格且精细地控制高纯金生产过程,为防止环境中杂质污染,整个过程需在洁净车间中进行。
随着集成电路往大型化发展,晶圆尺寸不断扩大,芯片制程不断缩小,对高纯金纯度要求会更高,未来纯度要求可能达到6N(99.9999%)以上,对高纯金靶材溅射性能及使用寿命的要求也会越严格,靶材尺寸也会更大,对靶材晶粒大小和组织均匀性的调控会更困难。高纯金及靶材制备企业应与下游企业加强交流与合作,共同商定高纯金及靶材行业标准,攻克关键技术,解决“卡脖子”难题,为实现中国高端半导体芯片用超高纯金和金靶材自主供应共同努力。
参考文献
[1] ZHANG L. Silicon process and manufacturing technology evolution: An overview of advancements in chip making [J]. IEEE Consumer Electronics Magazine, 2014, 3(3): 44-48.
[2] TANG J C, JIANG J F, GAO X Y, et al. Low-power 2D gate-all-around logics via epitaxial monolithic 3D integration [J]. Nature Materials, 2025, 24(4): 519-526.
[3] 何金江, 吕保国, 贾倩, 等. 集成电路用高纯金属溅射靶材发展研究 [J]. 中国工程科学, 2023, 25(1): 79-87.
[4] 李亚强, 马晓川, 张锦秋, 等. 芯片制程中金属互连工艺及其相关理论研究进展 [J]. 表面技术, 2021, 50(7): 24-43, 164.
[5] LUO J F, FANG Y Y, XU G J, et al. Development of ferromagnetic sputtering targets with high performance [J]. Mater. Science. Forum, 2020, 993: 820-825.
[6] CAO A, GONG Y, LIU D L, et al. Rapid fabrication of gold microsphere arrays with stable deep-pressing anisotropic conductivity for advanced packaging [J]. Nature Communications, 2024, 15: 9182.
[7] ZHANG L Q, WU X L, MIAO W Q, et al. Process of Au-free source/drain ohmic contact to AlGaN/GaN HEMT [J]. Crystals, 2022, 12(6): 826.
[8] MOHAMMAD S N. Contact mechanisms and design principles for nonalloyed ohmic contacts to n-GaN [J]. Journal of Applied Physics, 2004, 95(9): 4856-4865.
[9] WANG W C, LIU Z Y, QIU D L, et al. A method for fast Au-Sn bonding at low temperature using thermal gradient [J]. Micromachines, 2023, 14(12): 2242.
[10] KARBOWNIK P, TRAJNEROWICZ A, SZERLING A, et al. Direct Au‒Au bonding technology for high performance GaAs/AlGaAs quantum cascade lasers [J]. Optical & Quantum Electronics, 2015, 47(4): 893-899.
[11] 王美玉, 胡伟波, 孙晓冬, 等. 功率电子封装关键材料和结构设计的研究进展 [J]. 电子与封装, 2021, 21(10): 106-115.
[12] YAN C, ZHANG Q Y. Study on low-energy sputtering near the threshold energy by molecular dynamics simulations [J]. Aip Advances, 2012, 2(3): 032107.
[13] BAGHERPOUR E, PARDIS N, REIHANIAN M, et al. An overview on severe plastic deformation: research status, techniques classification, microstructure evolution, and applications [J]. International Journal of Advanced Manufacturing Technology, 2019, 100: 1647-1694.
[14] 王楠, 宋贵宏, 陈雨, 等. Ni掺杂对β-Cu2Se薄膜微观结构和热电性能的影响 [J]. 稀有金属, 2024, 48(3): 365-377.
[15] WU W H, YANG Y C, QIU H X, et al. Sustainable strategy for removing Ag impurities from crude gold via a vacuum distillation process to produce a 4N gold product [J]. Journal of Cleaner Production, 2025, 500: 145248.
[16] MAHYAPOUR H, MOHAMMADNEJAD S. Optimization of the operating parameters in gold electro-refining [J]. Minerals Engineering, 2022, 186: 107738.
[17] BALASUBRAMANIAN S K, YANG L, YUNG LY L, et al. Characterization, purification, and stability of gold nanoparticles [J]. Biomaterials, 2010, 31(34): 9023-9030.
[18] GOMES C P, ALMEIDA M F, LOUREIRO J M. Gold recovery with ion exchange used resins [J]. Separation and Purification Technology, 2001, 24(1-2): 35-57.
[19] COTTY S R, KIM N, SU X. Electrochemically mediated recovery and purification of gold for sustainable mining and electronic waste recycling [J]. ACS Sustainable Chemistry & Engineering, 2023, 11(9): 3975-3986.
[20] JUNG B H, PARK Y Y, AN J W, et al. Processing of high purity gold from scraps using diethylene glycol di-N-butyl ether (dibutyl carbitol) [J]. Hydrometallurgy, 2009, 95(3-4): 262-266.
[21] LI J S, SAFARZADEH M S, MOATS M S, et al. Thiocyanate hydrometallurgy for the recovery of gold. Part V: process alternatives for solution concentration and purification [J]. Hydrometallurgy, 2012, 113: 31-38.
[22] RAO M D, SINGH K K, MORRISON C A, et al. Recycling copper and gold from e-waste by a two-stage leaching and solvent extraction process [J]. Separation and Purification Technology, 2021, 263: 118400.
[23] 刘庆杰, 周洪杰, 李文军. 控制电位法在氰化金泥提纯黄金中的应用 [J]. 有色矿冶, 2019, 35(4): 30-32.
[24] 国家质量监督检验检疫总局.高纯金: GB/T 25933-2010[S].2010.
[25] 杨善晓, 尹昭锦, 李继刚, 等. 半导体用高纯金制备技术及应用研究进展 [J]. 贵金属, 2022, 43(增刊1): 68-74.
[26] 李英龙, 王玉贵, 吴宝元. 金基微合金强化研究综述 [J]. 有色矿冶, 1999, 15(5): 35-40.
[27] 张勤, 张俊凯, 厉英. 磁控溅射金基合金靶材的制备、应用及发展趋势 [J]. 材料导报, 2014, 28(5): 35-40.
[28] 谭志龙, 陈家林, 闻明, 等. 电子行业用高纯金溅射靶材研究综述 [J]. 贵金属, 2019, 40(2): 83-87, 94.
[29] 许彦亭, 郭俊梅, 王传军, 等. 贵金属溅射靶材的研究进展 [J]. 机械工程材料, 2021, 45(8): 8-14, 102.
[30] 禹泽海, 孙鹏, 汪春平, 等. 高纯铜溅射靶材的发展及现状 [J]. 山西冶金, 2007(5): 4-6.
[31] 贾国斌, 冯寅楠, 贾英. 磁控溅射用难熔金属靶材制作、应用与发展 [J]. 金属功能材料, 2016, 23(6): 48-52.
[32] 罗俊锋. 稀贵金属在磁记录靶材中的应用 [J]. 中国科技信息, 2011(18): 50.
[33] 国家市场监督管理总局.金及金合金靶材:GB/T 23611-2023[S].2023.
[34] 何金江, 陈明, 朱晓光, 等. 高纯贵金属靶材在半导体制造中的应用与制备技术 [J]. 贵金属,2013, 34(增刊1): 79-83.
[35] CHEN A L, PENG Z W, HWANG J Y, et al. Recovery of silver and gold from copper anode slimes [J]. JOM, 2015, 67(2): 493-502.
[36] 梁柱俊, 孙敬韬. 氯酸钠对铜阳极泥提取金的影响研究 [J].铜业工程, 2023(1): 144-147.
[37] MORRIS D, KHAN M A. Application of solvent extraction to the refining of precious metals-Ⅲ: purification of gold [J]. Talanta, 1968, 15(11): 1301-1305.
[38] 大连理工大学无机化学教研室.无机化学 [M]. 北京: 高等教育出版社, 2006: 693-697.
[39] 余建民.贵金属分离与精炼工艺学 [M]. 北京: 化学工业出版社, 2006: 150-151.
[40] 赵俊蔚, 赵国惠, 李健, 等. 氯酸钠法与王水法金泥提纯对比试验研究及工业应用 [J]. 黄金, 2017, 38(10): 63-66.
[41] ZHANG Z T, NIE H P. Extraction of gold from gold chloride solution by the depth reduction based on potential controlling in the process of treating copper anode slime [J]. JOM, 2022, 74: 234-239.
[42] 郭晓亮, 邓丰卓, 吕超飞, 等. 粗金粉中金的氯浸-控制电位还原精炼 [J]. 贵金属, 2022, 43(1): 54-60.
[43] 国家市场监督管理总局.金锭: GB/T 4134-2021[S].2021.
[44] 庄宇凯, 纪鹏. 二次氯化-二次还原法精炼高纯金工艺研究 [J]. 黄金, 2014, 35(2): 57-60.
[45] 李光胜, 王明双, 马涌, 等. 化学还原法制备高纯金试验研究 [J]. 黄金科学技术, 2015, 23(2): 103-106.
[46] 赵家春, 阳岸恒, 吴跃东, 等. 蒸发材料用高纯金的制备研究 [J]. 贵金属, 2021, 42(2): 27-31.
[47] 许晓阳. 溶剂萃取金的研究综述 [J]. 黄金, 2016, 37(7): 56-60.
[48] 中南矿冶学院. 从电子元件废料回收金并制取高纯金 [J]. 有色金属(冶炼部分), 1976(4): 35-38.
[49] 王芳举. 乙醚萃取法制备高纯金 [J]. 有色金属(冶炼部分), 1975(4): 22-24.
[50] 马荣骏.萃取冶金 [M]. 北京:冶金工业出版社, 2009: 699-700.
[51] 刘日辉, 解红琴, 霍利群. 二丁基卡必醇萃取金性能及机理的研究 [J]. 黄金, 1989(5): 45-49.
[52] 刘谟禧. 二丁基卡必醇萃取剂及萃取金工艺鉴定会 [J]. 有色金属(冶炼部分), 1984(1): 64.
[53] 刘谟禧. 二丁基卡必醇萃取法提金的研究 [J]. 矿冶工程, 1984(3): 36-40.
[54] 刘谟禧. 二丁基卡必醇萃取法提金扩大试验和试生产的工艺研究 [J]. 矿冶工程, 1984(4): 43-47.
[55] 刘谟禧, 张树峰, 孙树森. 二丁基卡必醇萃取法提金的工业实践 [J]. 矿冶工程, 1995(2): 37-40.
[56] 孙树森. 二丁基卡必醇萃取提金在生产中的应用 [J]. 有色金属(冶炼部分), 1992(5): 16-20.
[57] 孙根荣. 高纯金精炼试验研究 [J]. 黄金, 2015, 36(11): 61-63.
[58] 吴卫煌. 离心萃取制备高纯金的工艺研究 [J]. 黄金, 2018, 39(6): 50-55.
[59] HORIUCHI T, OSHIMA T, BABA Y. Separation of Au (Ⅲ) from other precious and base metals using 1-methoxy-2-octoxybenzene in acidic chloride media [J]. Hydrometallurgy, 2018, 178: 176-180.
[60] OSHIMA T, MIYAKE K. Au (Ⅲ) extraction using ketone compounds with physical properties superior to current commercial extractants [J]. AlChE Journal, 2021, 67(7): e17214.
[61] 沙鸥. 离子液体液液萃取分析应用研究 [D]. 扬州: 扬州大学, 2014.
[62] BOUDESOCQUE S, MOHAMADOU A, CONREUX A, et al. The recovery and selective extraction of gold and platinum by novel ionic liquids [J]. Separation and Purification Technology, 2019, 210: 824-834.
[63] 苏红梅. 双子型苯并咪唑类离子液体的合成及其萃取金的研究 [D]. 济南: 山东大学, 2020.
[64] 吴玉. 金的电解精炼技术条件的控制 [J]. 有色冶炼, 1984(11): 24-26.
[65] SCHALCH E, NICOL M J. A study of certain problems associated with the electrolytic refining of gold [J]. Gold Bulletin, 1978, 11(4): 117-123.
[66] MOSTERT P J, RADCLIFFE P H. Recent advances in gold refining technology at Rand Refinery [J]. Developments in Mineral Processing, 2005, 15: 653-670.
[67] MOOIMAN M B, Simpson L. Refining of gold-and silverbearing dore[M]// Gold Ore Processing: Elsevier, 2016: 595-615.
[68] 孙戬.金银冶金 [M]. 北京: 冶金工业出版社, 1986: 376-379.
[69] 王定良, 毛仕杰. 沃耳维尔法电解金的生产实践 [J]. 湖南冶金, 1989(2): 24-26.
[70] 盛枝, 张墨霞. 黄金电解电源 [J]. 白银科技, 1995(2): 50-53.
[71] 赵忱. 金电解电源装置的优化设计与应用 [J]. 矿冶, 2002, 11(3): 77-79.
[72] 赵忱. 交直流叠加在金电解中的应用 [J]. 设备管理与维修, 2003(3): 19.
[73] 付国民. 非对称交流电源在金电解生产中的应用 [J]. 黄金, 2000(5): 37-39.
[74] 郑勇. 周期(2π)换向金电解电源 [J]. 黄金, 1999(12): 29-33.
[75] 郑勇, 常占河, 李德俊. 周期自动换向金电解新工艺 [J]. 黄金, 1996(4): 35-38.
[76] GRANATO M, SOBRAL L G S. Electrorefining of high silver content gold bullion using pulsating currents [J]. Minerals Engineering, 1990, 3(5): 501-508.
[77] 柳旭, 张国清, 陈怡兰, 等. 国内电解精炼法制备高纯金综述 [J]. 贵金属, 2017, 38(4): 87-94.
[78] 夏志薇, 马坚刚, 夏兴旺, 等. 影响金电解电流效率的因素及对策 [J]. 铜业工程, 2021(6): 51-53, 80.
[79] 叶跃威. 高纯金的电解工艺 [J]. 贵金属, 2014, 35(1): 23-26.
[80] 叶跃威. 高杂质氰化金泥生产高纯金、高纯银实践 [J]. 贵金属, 2014, 35(增刊1): 7-11.
[81] 熊超. 金线用高纯金生产关键设备的研发实践 [J]. 铜业工程, 2012(3): 18-20.
[82] 董海刚, 赵家春, 吴跃东, 等. 高纯金制备技术研究进展 [J]. 贵金属, 2022, 43(2): 76-80.
[83] 孙敬韬, 邓成虎, 王日, 等. 一步法高纯金生产工艺开发与产业化 [J]. 有色金属(冶炼部分), 2014(7): 45-48.
[84] 杨国祥, 邓志明. 键合金丝用高纯金的制备 [J]. 贵金属, 2010, 31(2): 54-56.
[85] 马贤杰, 陈斐, 刘丹, 等. 离子交换法净化金电解液的研究 [J]. 贵金属, 2020, 41(增刊1): 120-124.
[86] 刘俊林, 周兴, 陈德海, 等. 新型电解精炼高纯金试验研究 [J]. 云南冶金, 2023, 52(1): 86-89.
[87] LE FEBVRIER A, LANDÄLV L, LIERSCH T, et al. An upgraded ultra-high vacuum magnetron-sputtering system for high-versatility and software-controlled deposition [J]. Vacuum, 2021, 187: 110137.
[88] GARG R, GONUGUNTLA S, SK S, et al. Sputtering thin films: materials, applications, challenges and future directions [J]. Advances in Colloid and Interface Science, 2024, 330: 103203.
[89] 姚甜, 王新锋, 刘李旭, 等. 粉末冶金技术在溅射靶材制备中的研究现状 [J]. 热加工工艺, 2024, 53(7): 7-10, 36.
[90] 杨晓东, 李小珍, 邢孟江. 一种高纯高均匀性金靶材及其制备方法与应用: CN110938799B [P]. 2022-07-29.
(注,原文标题:高纯金及金靶材制备工艺研究进展)
相关链接