钛合金植入材料是一种用于生物医学领域的功能性结构材料,具有密度小、比强度高、生物相容性优于不锈钢和钻基合金等优点,主要被用于制造人工关节假体、牙种植体以及心血管支架等产品,具有广阔的应用前景[1-3]。但钛合金植入材料的性能与自然骨相比仍有很大差距,生物相容性有待提高。首先,钛合金植入材料表面结构与人体组织差异较大,无法与周围组织直接形成良好的骨结合,易导致手术失败W此外,钛合金植入材料的弹性模量与人体骨骼弹性模量相比明显偏高,会产生应力屏蔽效应。以Ti-5Al-2.5Fe和Ti-6Al-7Nb为代表的α+β钛合金的弹性模量为100~110 GPa,新开发的一些β型钛合金弹性模量为40 -100 GPa,而人体密质骨的弹性模量为4~30GPa,松质骨的弹性模量仅为1~2 GPa[6 7] 。
提高植入材料生物相容性的手段主要有等离子喷涂法和离子注入法等[8,9]。前者是以等离子电弧作为热源,将陶瓷、纯金属、合金等材料加热到熔融或半熔融状态后喷向工件表面,从而形成表面改性层的方法;后者是在真空靶室中将高能离子束射到基材表面,从而在其表面获得具有特定性能的改性涂层。众多研究证明,离子注入法可以显著改善钛合金植入材料的生物相容性、耐腐蚀性和抗菌性。Qin等少[10]利用等离子体浸没离子注入技术在钛植入体表面制备了载有纳米银颗粒的TiO2纳米管涂层,大幅提高了钛植入体的抗菌性。
通常,通过添加微量元素、设计新型低模量β钛合金或调整多孔钛合金孔隙率的途径来解决钛植入体弹性模量与人体骨骼差异较大的问题[11,12]。由于人体骨骼是从内部疏松骨质向表面致密骨质逐渐变化的,是典型的梯度多孔结构。故开发与人体骨骼具有良好力学相容性和生物相容性的仿生结构钛合金植入材料成为近年来的研究热点。
为此,从表面结构及梯度结构两方面对仿生结构钛合金植入材料的制备及发展现状进行介绍,以期为钛合金植入材料综合性能的优化提供参考。
1、表面仿生结构钛合金及制备方法
仿生材料是通过模拟生物材料结构和生命系统运行模式而设计制造的一种人工材料。仿生设计的实现,需要模拟生物体的结构及其功能[13]。人体骨骼表面具有不同大小的凹坑和沟槽,其中,直径1~100μm的微孑L可以促进细胞的生长,1~100μm的微孔可以促进细胞的增殖和蛋白质的合成。因此,根据仿生学理念,将材料表面结构设计为微孔结构,能够增大植入材料的比表面积,提高表面能,更好地诱导植入体周围骨组织的生长,进一步提升材料的生物相容性。
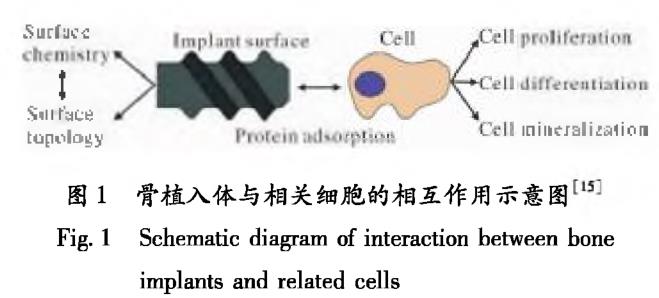
骨植入体对骨组织的修复效果主要取决于相关细胞的行为[14]。图1为骨植入体与相关细胞的相互作用示意图[15]。当植入材料与人体血液接触时,血液中的某些蛋白质会吸附在植入材料表面[16]。材料的表面结构一方面会影响其表面蛋白的组成及数量,进而影响相关细胞的增殖、分化以及矿化;另一方面,表面结构会对细胞与材料表面的接触面积产生一定的影响,进而影响细胞粘着斑的形成和细胞铺展的形态[17,18]。故植入材料需要提供合适的表面结构,这样细胞才能与材料表面的一些特定蛋白质发生作用,进而稳定贴附于植入材料表面并对细胞外的信号进行响应,从而将植入材料表面信息转化为生物信号。目前,适用于钛合金材料的仿生表面改性方法主要包括电化学沉积技术、激光熔覆技术及复合改性技术等。
1.1电化学沉积技术
电化学沉积技术是在外电场作用下,调节电极表面化学环境,通过氧化还原反应,使溶液中的离子沉积到电极表面形成涂层[19]。其突出优点是可以在复杂形状钛植入体表面和多孔钛基体表面制备涂层。
Li等[20]利用电化学沉积法将含羟基磷灰石(HA)的碳化硅(SiC)纳米颗粒沉积在阳极氧化的钛纳米管表面。研究表明,钛阳极表面覆盖SiC-HA纳米颗粒后,能够有效促进成骨细胞的黏附。尹林玲[21]采用电化学沉积技术在钛基体表面制备出一种载有壳聚糖/明胶/纳米银/氧化锌的新型钛纳米管复合涂层。该复合涂层具有良好的抗菌性能和生物相容性,能够有效促进细胞的增殖和分化。彭晴血]采用电化学沉积法在经阳极氧化处理后的钛植入体表面制备出Ti/TiO2/HA复合涂层。研究表明,HA表面的晶粒为纳米尺寸,呈垂直状排列;复合涂层与钛基体的结合强度较高,为26.7 MPa,且表面细胞生长良好,具有很好的生物相容性。毛世琪[23]采用电化学沉积法在钛基底表面制备出氧化石墨烯/HA复合涂层,该涂层微观形貌均呈现棒状多孔结构。由于氧化石墨烯具有良好的生物亲和性,故该复合涂层的生物亲和性相较于单一 HA涂层明显提升。
1.2激光熔覆技术
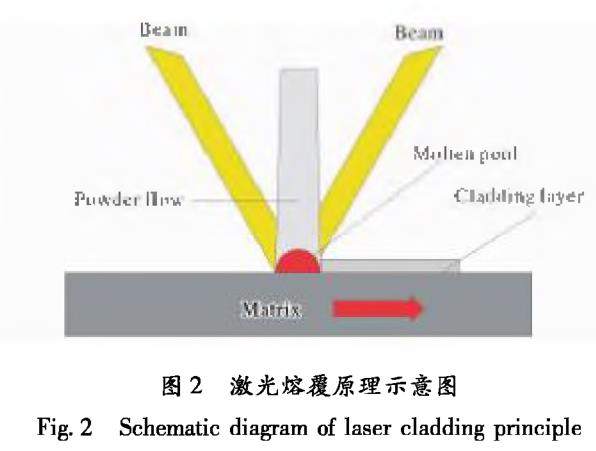
激光熔覆技术是利用高能激光束快速熔化金属表面层和粉末材料形成熔池,之后再冷却形成具有特殊性能的涂层[24,25]。图2为激光熔覆原理示意图。该技术通过在基体表面形成熔覆层弥补基体材料性能的不足,并且可以在指定的区域进行精确加工,具有较高的加工效率。
刘楠[26]首先在钛植入体表面构建了仿树蛙皮肤形貌的六边形纳米结构,然后利用激光熔覆法制备出线阵列分布的钛酸钙(CaTiO3 )涂层。研究表明,CaTiO3涂层具有良好的生物相容性,并且可以使骨组织与植入体之间牢固结合。Branemark等[27]利用激光对牙种植体进行处理,在牙种植体表面形成具有微纳米尺度的复合结构。植入实验结果表明,经激光处理后植入体的力学相容性和骨整合性能更好。门博[28]通过激光熔覆技术在TI6Al4V合金表面构建了微结构阵列,并通过进一步酸蚀去除表面熔渣,从而形成多尺度的微纳复合结构。研究表明,激光熔覆+酸蚀处理获得的微纳结构具有良好的生物相容性,有助于细胞的黏附和增殖。
1.3复合改性技术
由于植入材料与人体骨骼的相互作用错综复杂,为制备出适宜人体内部环境的植入材料,有时需要将不同技术结合起来。付小明[29]采用微弧氧化法(MAO)以及水热处理技术,在Ti25Nb3Zr3Mo2Sn合金表面制备出粗糙多孔的纳米HA仿生涂层。研究表明,该涂层结构与牙本质-牙骨质复合体结构相似,具有良好的生物相容性和较低的弹性模量。Li等[30]首先利用MAO法在钛基体表面涂覆一层多孔TiO2薄膜,然后将试样放入碱性溶液中进行电化学还原,通过双涂层工艺,制备了表面具有独特微/纳米形貌的钛植入体。体内和体外实验表明,改性后细胞的初始黏附能力明显增强,更有利于细胞的增殖。这种双涂层工艺在提高钛表面骨整合性能方面具有广阔的应用前景。黄千里[31]利用激光选区熔化成形技术(SLM)制备出Ti6A14V合金部件,并将MAO与水热处理相结合,在其表面构建了含铜的仿生微纳拓扑结构涂层。研究表明,该涂层具有抗菌和促进成骨的功能,在植入体表面改性领域有较大的应用潜力。许莹等[32]采用阳极氧化法在钛基体表面原位生长TiO2纳米氧化层,然后采用溶胶凝胶法在纳米氧化层表面涂覆具有生物活性的微晶玻璃涂层(BGC),最终得到Ti/TiO2/BGC复合涂层。该复合涂层在模拟体液中浸泡后表面会生成大量的HA,表现出优良的生物相容性,且涂层亲水性强,与基体结合强度高。王变[33]首先对钛表面进行酸处理,获得了微米台阶结构,然后利用水热法在具有微米台阶的钛表面原位生长TiO2纳米棒,之后再采用等离子喷涂法喷涂钳粉末,最终制备出TiO2/Ta复合涂层。模拟体液生物活性实验表明,相较于未经处理的钛金属,涂覆有复合涂层的钛金属表面沉积的HA更多,具有更优异的生物相容性。
2、梯度结构钛合金及制备方法
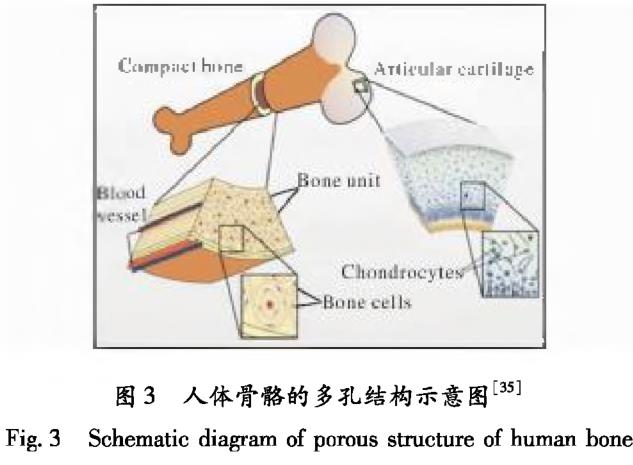
人体骨骼由内部的松质骨和外部的密质骨构成,最外层由微米级别的血管和层状结构的骨单位组成。其中,骨单位由HA纳米颗粒以及纳米胶原分子组成,孔隙率从内向外呈梯度变化。密质骨的压缩强度在100 ~230 MPa之间,孔隙率在5% -10%之间;松质骨的压缩强度在0.3-1.5 MPa之间,孔隙率在40% -90%之间⑶]。图3为人体骨骼的多孔结构示意图回。
许多生物材料在局部化学组成或结构方面亦呈现出空间梯度特征,这种梯度结构在提高生物材料力学性能的同时可赋予其一定的功能。Miao等[36]将梯度多孔材料分为化学成分梯度多孔材料、孔径梯度多孔材料和孔隙率梯度多孔材料。梯度多孔材料的成分和组织呈连续变化,没有明显的界面,不同位置的性能也不同。根据不同的使用要求,可以通过优化梯度结构材料的成分、组织以及结构来满足不同部位的性能需求,并且梯度结构能够降低材料的弹性模量,提高强度,满足以往均匀结构无法满足的使用条件。常用的梯度材料制备方法有粉末冶金法、等离子喷涂法以及3D打印技术。
2.1粉末冶金法
粉末冶金是以金属粉末(或金属粉末与非金属粉末的混合物)为原料,通过压制成型、烧结制造金属制品的方法。该技术能够较好地控制多孔材料的孔隙率和孔隙结构,已广泛用于多孔材料的制备。与传统的熔铸法相比,可以减少或消除合金的成分偏析,提高制品性能,且生产工艺简单,周期较短。
张帅[37]采用粉末冶金法,在内外两层添加不同含量的NH4HCO3造孔剂,制备出新型医用双层梯度多孔Ti-14Mo-2.1Ta-0.9Nb-7Zr合金。该合金的弹性模量约为20.91 GPa,抗压强度约为1420 MPa,与人体密质骨基本匹配。Mihalcea等[38]利用粉末冶金技术制备了双层结构的植入体,其上层为致密的20CoCrMo,下层为多孔的Ti6A14Vo研究表明,双层Ti6A14V/20CoCrMo植入体内部没有裂纹,耐腐性能良好,有较高的耐磨损性和较长的体内寿命。王月勤等[39,40]创通过仿骨骼结构进行设计,以NH4HCO3为造孔剂,制备出与人体骨骼结构类似的梯度Ti-Mg复合材料。研究表明,随着复合材料层数的增加,试样的强度和弹性模量先升高后降低,其中5层梯度结构试样的强度最高,抗弯强度为16&3 MPa,抗弯模量为2.3 GPa;梯度结构Ti-Mg复合材料层间结合良好,未出现层间剥离现象。
2.2等离子喷涂法
等离子喷涂法是利用直流电弧使气体电离进而形成等离子流,然后通过高速喷射离子流使熔融粒子与基体碰撞在表面堆积形成涂层。通过控制颗粒的熔化状态和界面温度,可以得到成分和结构逐渐变化的梯度结构材料。
Singh等[41]采用大气等离子喷涂工艺(APS)在TI6A14V合金表面连续喷涂3层功能梯度涂层,成功制备出每层成分都不同的成分梯度材料。内层涂覆TiO2粘结层,以提高涂层结合强度;中间层涂覆结晶的HA并进行热处理,有助于提高界面之间的黏附性;外层喷涂HA层,较高的表面粗糙度和孔隙率可促进种植体与宿主骨骼的结合。研究表明,所制备的梯度结构各界面之间结合良好,梯度材料外层较高的孔隙率为骨组织提供了良好的生长条件。
Kumari等[42]利用等离子喷涂技术在TI6Al4V合金表面制备了 HA-50% TiO2 (质量分数,下同)和HA-10%ZrO2双层梯度结构涂层。相较于只沉积HA-50% TiO2 或HA-10%Zr()2的单一结构涂层,双涂层试样具有更好的生物相容性。鲍雨梅等[42]利用同样的方法在钛基体表面分别制备了 HA/ZrO2和HA/HA-ZrOz/ZrO2梯度涂层。研究表明,该涂层各层间结合紧密,且结合强度随着ZrO2层厚度的增加而增加,同时ZrO2不会影响其生物活性。Khor等理利用等离子喷涂在钛合金表面制备了 HA涂层和HA-Ti6A14V梯度涂层。研究表明,HA-Ti6A14V梯度涂层与基体的结合强度明显高于单一 HA层,并具有良好的力学性能和生物学性能。Ning等[45]采用等离子喷涂工艺成功在Ti6Al4V合金表面制备出新型HA-ZrtVTi梯度涂层。研究发现,涂层的成分以及显微组织呈梯度变化,不同涂层之间无明显的界面;热处理后梯度涂层的结合强度达到53.6 MPa,远高于单一HA涂层。
2.3 3D打印技术
3D打印技术又被称为“快速成形技术”,是将计算机设计出的三维数字模型分解成若干层平面切片,然后由3D打印机把金属粉末等材料按切片图形逐层叠加,最终得到完整物体的增材制造技术。该技术在生物多孔材料制备方面有着独特优势。因采用的成形方法和使用的热源不同,3D打印技术又可分为选择性激光烧结成形(SLS)、激光选区熔化成形(SLM)、激光立体成形(LSF)、电子束选区熔化成形(EBSM)和电子束熔丝沉积成形(EBF)等。这些技术中,EBSM的成形精度相对较高,而且电子束功率大,成形效率高,可以有效解决SLM不能成形大尺寸工件的劣势,具有更好的发展前景。表1对常见的钛合金3D打印技术进行了对比跑。

Pei等⑷]首先利用计算机辅助设计软件(CAD)设计了互连多孔结构产品,然后通过有限元模拟的方法对产品的力学性能进行模拟研究并进一步优化,最后以TI6A14V合金粉末(粒径50~100 μm)为印刷材料,采用SLM技术制造出用于修复股骨头的钛植入体。该植入体的抗压强度、弹性模量(约3.61 GPa)介于密质骨与松质骨之间,且其多孔结构十分有利于骨修复和再生。李磊[48]通过3D打印技术制备出仿生多孔钛骨。研究表明,该仿生多孔钛骨表面为尺寸一致的网格状结构,孔隙分布均匀,相互贯通,有利于血液快速进入孔内,促进成骨细胞在多孔钛骨表面附着,缩短骨结合时间,具有良好的生物学
性能。Fousovd等网以气体雾化法制备的Ti6Al4V合金粉末为原料,采用SLM技术制备了 3种不同孔隙率的柱状多孔试样,其中1#、2#试样仅外层多孔,孔隙率分别为37.9%、62.1% , 3锻样为全多孔钛,孔隙率为79.2% ,如图4所示。研究表明,通过改变孔隙率可以调整多孔钛的力学性能,当孔隙率为62.1%时,多孔钛的杨氏模量约为30.5 GPa,与人体骨骼相近,可有效缓解应力屏蔽效应。

钛合金3D打印技术作为一项前沿技术,可以灵活控制孔隙参数,并根据需要的形状实现个性打印,具有广阔的发展前景。然而,该技术在国内发展时间较短,仍存在精度较低、设备及粉末原料成本较高、成形件易产生缺陷(球化、裂纹、孔隙、翘曲变形)等亟待解决的问题。
3、结语
仿生结构钛合金植入材料的制备方法较多,但大多尚不完善,还有很大的发展空间。利用粉末冶金法制备梯度多孔结构材料时,非均质粉末压坯固化极容易引起材料的非均匀收缩,仍需加强对制备工艺的研究。3D打印技术虽容易控制孔隙结构,但对粉末材质及设备的要求较高,成形过程中缺陷的产生机理、新型钛合金粉末的开发、成形材料强度的提高仍是今后研究的重点。
此外,虽然仿生结构钛合金在近年来已得到较快的发展,但在临床应用方面仍受到一定的限制,因此,在进行创新性研究的同时,需加大其在医用领域的成果转化投入,进一步推动仿生结构钛合金的发展和应用。
参考文献 References
[1] 张文毓.生物医用金属材料研究现状与应用进展[J].金属世界,2020(1): 21 -27.
[2] 任军帅,张英明,谭江,等.生物医用钛合金材料发展现状及趋势[〕]•材料导报,2016, 30 ( Z28 ) : 384-388
[3] 武秋池,纪箴,贾成厂,等.钛及钛合金人体植入材料研究进展[J].粉末冶金技术,2019, 37 ( 3 ) : 225-232.
[4] 麻西群,于振涛,牛金龙,等.新型生物医用钛合金的设计及应用进展[J].有色金属材料与工程,2018, 39(6): 26-31.
[5] 于振涛,余森,程军,等.新型医用钛合金材料的研发和应用现状[J].金属学报,2017, 53 ( 10 ) : 1238-1264.
[6] 贾建刚,井勇智,高昌琦,等.骨移植多孔钛材料制备方法与发展概况[J].中国有色金属学报,2019, 29(6): 1187-1197.
[7] 石志良,黄琛,卢小龙,等.Sphere梯度孔结构力学性能有限元分析[J].中国生物医学工程学报,2019, 38(3): 339 -347.
[8] Zheng J P, Chen L J, Chen D Y, et al.Effects of pore size and porosity of surface-modified porous titanium implants on bone tissue ingrowth [ J].Transactions of Nonferrous Metals Society of China, 2019 , 29(12) : 2534 - 2545.
[9] 裴宇梁.医用金属材料表面功能涂层的构建及其生物学性能的研究[D].太原:太原理工大学,2019.
[10] Qin H, Cao H L, Zhao Y C, et al.In vitro and in vivo antibiofilm effects of silver nanoparticles immobilized on titanium [J].Biomaterials, 2014, 35: 9114 -9125.
[11 ] Cai D G, Zhao X T, Yang L, et al.A novel biomedical titanium alloy with high antibacterial property and low elastic modulus [J].Journal of Materials Science & Technology,2021, 81: 13 -25.
[12] Li P Y, Ma X D, Tong T, et al.Microstructural and mechanical properties of jB-type Ti-Mo-Nb biomedical alloys with low elastic modulus [ J ].Journal of Alloys and Compounds, 2020, 815 : 152412.
[13] Zhao Y Q, Tang R K.Improvement of organisms by biomi metic mineralization: a material incorporation strategy for biological modification [ J ].Acta Biomaterialia, 2021,120: 57-80・
[14] 王滕.钛合金植入体微纳双级结构表面设计制造及其生物相容性研究[D].济南:山东大学,2017.
[15] Gittens R A, Olivares-Navarrete R, Schwartz Z, et al.Implant osseointegration and the role of microroughness and nanostructures : lessons for spine implants[ J].Acta Biomaterialia, 2014, 10(8) : 3363 -3371.
[16] Wilson C J, Clegg R E, Leavesley D I, et al.Mediation of biomaterial-cell interactions by adsorbed proteins: a review [J].Tissue Engineering, 2005, 11( 1/2) : 1 - 18.
[17] Olivares-Navarrete R, Rodil S E, Hyzy S L, et al.Role of integrin subunits in mesenchymal stem cell differentiation and osteoblast maturation on graphitic carbon-coated microstructured surfaces [ J ]・ Biomaterials, 2015, 51: 69-79.
[18] Jeon H J, Simon C G, Kim G H.A mini-review: cell response to microscale, nanoscale, and hierarchical pattern ing of surface structure [ J ].Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2015, 102 ( 7 ):1580 - 1594.
[19] 叶伟.钛表面电化学沉积纳米疑基磷灰石涂层研究[D].杭州:浙江大学,2007.
[20] LiT, LiXL, Hu X S, et al.Enhanced osteoporotic effect of silicon carbide nanoparticles combine with nano hydroxyapatite coated anodized titanium implant on healthy bone regeneration in femoral fracture[ J].Journal of Photo-chemistry & Photobiology B: Biology, 2019, 197: 111515.
[21] 尹林玲.新型钛纳米管复合涂层的抗菌和成骨活性研究[D].上海:上海交通大学,2019.
[22] 彭晴.纯钛表面Ti()2纳米管及纳米径基磷灰石(nHA)制备与性能研究[D].湘潭:湘潭大学,2015.
[23] 毛世祺.钛基底上电化学沉积轻基磷灰石涂层[D].郑州:郑州大学,2020.
[24] Dey D, Bal K S, Singh A K, et al.Hardness and wear behaviour of multiple component coating on Ti-6A1-4V sub strate by laser applicationf J].Optik, 2020, 202: 163555.
[25] Li X, Zhang C H, Zhang X, et al.Manufacturing of Ti3 SiC2 lubricated Co-based alloy coatings using laser cladding technology [ J ].Optics and Laser Technology,2019, 114: 209-215.
[26] 刘楠.钛基人工骨表面微纳结构设计制造及其生物相容性的研究[D].西安:陕西科技大学,2019.
[27] Branemark R, Emanuelsson L, Palmquist A, et al.Bone response to laser-induced micro- and nano-size titanium sur face features [J].Nanomedicine: Nanotechnology, Biology,and Medicine, 2011, 7(2) : 220 -227.
[28] 门博.钛合金表面微纳结构设计制造及其生物活性研究[D].济南:山东大学,2015.
[29] 付小明.低弹性模量仿生种植体的基础研究[D].福州:福建医科大学,2013.
[30] Li G L, Cao H L, Zhang W J, et al.Enhanced osseointe gration of hierarchical micro/nanotopographic titanium fabri cated by microarc oxidation and electrochemical treatment[J].Journal of Technology, 2016, 8(6) : 3840 -3852.
[31] 黄千里.医用钛合金的选择性激光熔化成型与钛表面电化学改性[D].北京:清华大学,2017.
[32] 许莹,何世宇,王欢欢,等.Ti/TiO2/BGC生物活性复合材料的制备及其性能研究[J].钢铁飢钛,2018, 39(3): 33 -39.
[33] 王变.医用钛基金属表面纳米结构的构建及性能研究[D],唐山:华北理工大学,2018.
[34] 许莹,王欢欢,王变.医用多孔0钛合金的制备方法研究进展[J].钛工业进展,2018, 35(3): 1 -5.
[35] Stevens M M, George J H.Exploring and engineering the cell surface interface [ J ].Science, 2005, 310 ( 5751 ):1135 -1138.
[36 ] Miao X G, Sun D.Graded/gradient porous biomaterials[J].Materials, 2010, 3(1) : 26-47.
[37] 张帅.新型医用梯度多孔Ti-Mo-Ta-Nb-Zr合金制备与组织性能研究[D].贵阳:贵州大学,2016.
[38] Mihalcea E, Vergara-Hemandez H J, Jimenez 0, et al.Design and characterization of Ti6A14V/20CoCrMo-highly porous Ti6A14V biomedical bilayer processed by powder metallurgy [J].Transactions of Nonferrous Metals Society of China, 2021, 31(1) : 178 - 192・
[39] 王月勤 低模量多孔Ti・Mg系生物复合材料的制备与性能研究[D].南京:南京航空航天大学,2010.
[40] 张金龙.梯度多孔Ti-Mg基生物复合材料的制备与性能研究[D].南京:南京航空航天大学,2011.
[41 ] Singh J, Chatha S S, Singh H.Synthesis and characterization of plasma sprayed functional gradient bioceramic coating for medical implant applications [J].Ceramics International,2021, 47(7): 9143 -9155.
[42] Kumari R, Majumdar J D・ Studies on corrosion resistance and bio-activity of plasma spray deposited hydroxylapatite (HA) based TiO2 and ZrO2 dispersed composite coatings on titanium alloy ( Ti-6A1-4V) and the same after post spray heat treatment [ J ].Applied Surface Science, 2017, 420(5): 935 -943.
[43] 鲍雨梅,陈贺,王成武.HA/ZK)2梯度涂层的制备及其抗冲击性能研究[J]・浙江工业大学学报,2019, 47(3): 237-242.
[44] Khor K A, Gu Y W, Quek C H, et al.Plasma spraying offunctionally graded hydroxyapatite/Ti-6Al-4V coatings [ J].Surface & Coatings Technology, 2003, 168 ( 2 ) : 195-201.
[45] Ning C Y, Wang Y J, Chen X F, et al.Mechanical performances and microstructural characteristics of plasma-sprayed bio-functionally gradient HA-ZrO2-Ti coatings [ J ].Surface & Coatings Technology, 2005 , 200 ( 7 ) : 2403_2408
[46] 唐超兰,温竟青,张伟祥,等.钛合金3D打印成形技术及缺陷[J].航空材料学报,2019, 39(1): 38-47.
[47] Pei X, Zhang B Q, Fan Y J, et al.Bionic mechanical design of titanium bone tissue implants and 3D printing manufacture] J].Materials Letters, 2017, 208 (4) : 133-137.
[48] 李磊.3D打印仿生钛骨表面复合涂层对成骨细胞相容性及抑菌性能的研究[D].青岛:青岛大学,2017.
[49] Fousova M, Vojtech D, Kubasek J, et al.Promising characteristics of gradient porosity Ti-6A1-4V alloy prepared by SLM process [J].Journal of the Mechanical Behavior of Biomedical Materials, 2017, 69: 368 -376.
相关链接