医用钛合金以其良好的生物相容性、高比强度和低弹性模量以及在生物环境下优良的耐腐蚀性等优点,在临床上已成为广泛的植入材料[1-3],如骨科硬组织、口腔以及颅颌面骨等部位的重建与修复[4,5]。对于结构复杂的钛合金骨科植入物制造,传统的减材制造技术,难以实现骨组织的结构和生物力学的重现。随着计算机辅助设计技术的日趋完善,3D打印技术与之结合,能够针对人体骨组织不同缺损部位和形状制造出具有复杂形状和微孔特征的植入物,对骨科钛基医用金属植入物而言,解决了“形”和“孔”的难题,从而实现植入物形状和骨长入性能与宿主骨的适配,因此自3D打印钛合金植入物上市以来,在骨科领域发挥着越来越重要的作用[6-8]。3D打印医用钛合金植入物多孔结构可以促进骨组织的长入,不仅能够加强植入物与骨组织的生物固定,还可能使应力沿植入物向周围骨传递[9-11]。Schmidt等[12]研究表明,在三维多孔结构中的细胞,将会促进孔隙内的组织分化,并指出三维多孔结构更有利于干细胞向成骨细胞而非纤维细胞的分化,3D打印多孔钛合金的表面形貌对成骨细胞的粘附、增殖以及骨胶原基质的沉积具有积极的作用。由于以上优势,3D打印多孔Ti-6Al-4V钛合金植入物已经在关节、骨盆肿瘤和脊柱疾病等治疗上应用,在临床上已经取得了显著疗效[13-16]。
3D打印多孔Ti-6Al-4V钛合金植入物除了良好的骨长入性能外,要保证其良好的临床效果还依赖于其与组织器官的反应处于可接受水平。特别是三维多孔结构增大了植入物的比表面积,因多孔结构造成暴露于体液介质的表面积增大,三维贯通的孔隙结构引起缝隙腐蚀概率更高,导致比传统的实体钛合金更易析出具有潜在毒性的Al/V等金属离子。Jonitz等[17]通过体外静态细胞试验研究了3D打印多孔钛合金的生物相容性,结果显示在磨损过程中释放出V离子,诱导活性自由基的释放,从而对细胞的存活产生不利的影响。已有研究证实Al/V是对生物体有潜在毒副作用的元素,特别是V的生物毒性要超过Ni/Cr[18],因此,减少或避免3D打印多孔Ti-6Al-4V钛合金植入物的金属离子析出,是进一步提高3D打印钛合金植入物安全有效性的有力措施。
KGulati等[19]利用阳极氧化技术在3D打印的钛合金表面形成二氧化钛,与传统的钛材料相比,用人成骨细胞检测该3D打印钛合金植入物的骨整合特性显示成骨细胞的粘附力增强。因此,阳极氧化可以提高医用钛合金的生物相容性。已有的研究结果表明,传统的钛合金经过阳极氧化,能够大大提高植入物的耐腐性,也在一定程度上能够解决Al/V等金属离子析出的问题[20,21]。虽然阳极氧化在传统的钛合金骨科植入物上广泛应用,但阳极氧化的3D打印多孔钛合金骨科植入物研究与产品的临床应用报道并不多见。
因此研究阳极氧化的3D打印多孔医用Ti-6Al-4V钛合金的性能变化,尤其是离子析出特性,对于丰富3D打印医用钛合金基础研究资料,以及开发相应的植入器械具有重要指导意义。本文以电子束熔融技术打印的多孔Ti-6Al-4V钛合金为例,采用着色阳极氧化工艺在3D打印多孔钛合金表面制备氧化膜,研究了阳极氧化前后的3D打印多孔钛合金显微组织结构和表面形貌变化,重点探讨了阳极氧化表面处理前后在Hank′s模拟体液中的离子析出行为。
1、材料与方法
1.1多孔Ti-6Al-4V钛合金着色阳极氧化
试验采用电子束熔融设备(Arcam,Q10plus)打印多孔Ti-6Al-4V钛合金,成分符合GB/T13810-2017[22]规定,尺寸为φ10mm×10mm,通过Magics软件对多孔钛合金的表面积进行测算,表面积约为15cm2,多孔结构的丝径约为600μm,孔径约为750μm,孔隙率约为65%。样件经过丙酮清洗、纯化水超声清洗、干燥后进行着色阳极氧化。着色阳极氧化在0.6mol/L硫酸溶液中进行,以样件作为阳极,不锈钢作为阴极,在电压20V时,对样件氧化5min后取出。将阳极氧化表面处理的样件记为AIPS10/10型,作为试验组,未做处理的记为IPS10/10型,作为对照组。
对样件采用体积比为3∶7∶90的氢氟酸、硝酸和水的混合溶液进行腐蚀,并借助Axiovert200MAT/Zeiss光学显微镜进行显微组织的观察。采用JSM-IT300扫描电镜观察样品表面形貌并进行能谱分析。
1.2金属离子析出试验
以Hank′s人工模拟体液作为浸提液,按照空白组(未加入钛合金样件)、对照组(加入3D打印多孔Ti-6Al-4V钛合金样件IPS10/10)和试验组(加入经着色阳极氧化3D打印多孔Ti-6Al-4V钛合金样件AIPS10/10)分类,将浸提液按照样品表面积与浸提溶液体积1∶1的比例添加至离心管,密封放置在37℃的恒温保温箱(生产企业:上海一恒,型号:LRH-250),设定浸提时间为1d,1周,3周和5周。
每组样品到达浸提时间后,采用电感耦合等离子体质谱仪(ICP-MS,Agilen,7800)测定Al离子、V离子和Ti离子的浓度。
2、结果
2.1多孔Ti-6Al-4V钛合金着色阳极氧化
3D打印多孔Ti-6Al-4V钛合金阳极氧化前后的样件如图1所示,左侧银灰色柱状多孔样件为3D打印完成后的钛合金样件IPS10/10,在光学照片下可以看到多孔结构;右侧紫红色柱状样件为经过着色阳极氧化后的3D打印多孔钛合金样件AIPS10/10,可以看到氧化前后对产品的宏观形貌没有改变。

2.2显微组织
图2所示为3D打印多孔Ti-6Al-4V钛合金阳极氧化前后的金相组织照片。3D打印的多孔Ti-6Al4V合金的组织为α+β相,如图2(a)和图2(b)中所示,连续的晶界α相清晰可见,其间有片层状的β相。经过阳极氧化后,如图2(c)和图2(b)所示,多孔钛合金显微组织与氧化前基本一致,均为等轴晶的α+β相,晶粒较为粗大,相邻α相片层组织之间存在尺寸很小的β相,存在部分等轴晶和连续的晶界α相。由此说明阳极氧化对3D打印多孔Ti-6Al-4V钛合金的显微组织结构没有影响,双相钛合金的组织结构没有变化。Ti-6Al-4V是代表型的α+β两相钛合金,合金的微观组织特征决定了合金的力学性能,3D打印多孔Ti-6Al-4V钛合金阳极氧化前后显微组织一致,因此作为植入物的3D打印多孔合金的力学性能亦不会发生变化。

图3(a)和图3(b)所示为3D打印多孔Ti-6Al4V钛合金阳极氧化前后的SEM照片,从图中可以看出阳极氧化前后,多孔钛合金丝径形貌与尺寸未发生明显变化,多孔结构的丝径和孔径未受到影响。
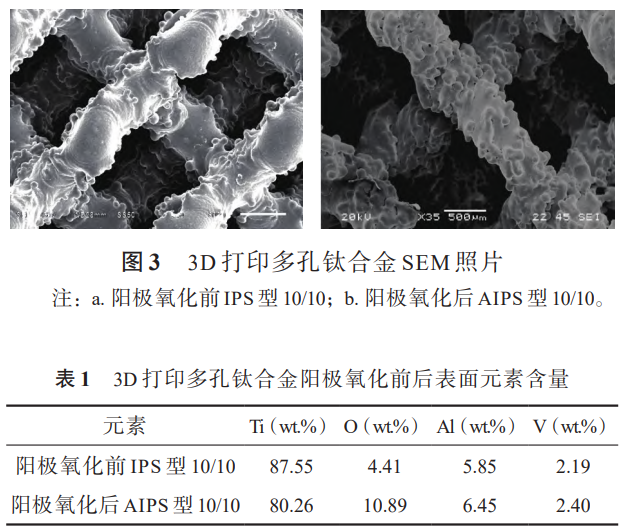
3D打印多孔钛合金表面熔融的钛合金球形颗粒,经过阳极氧化后仍然存在。表1为对应的阳极氧化前后多孔钛合金表面的元素含量。
2.3金属离子析出
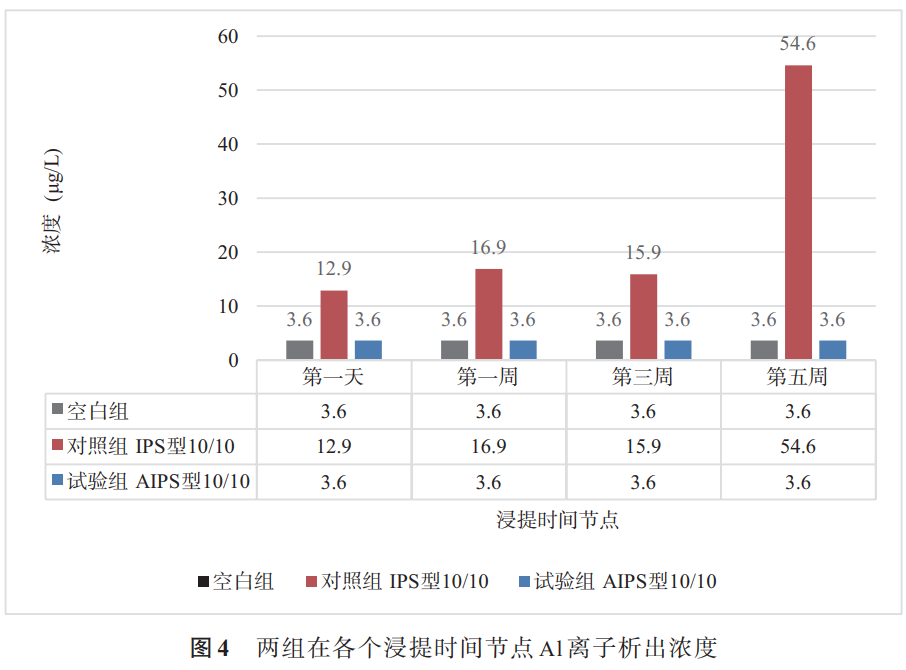
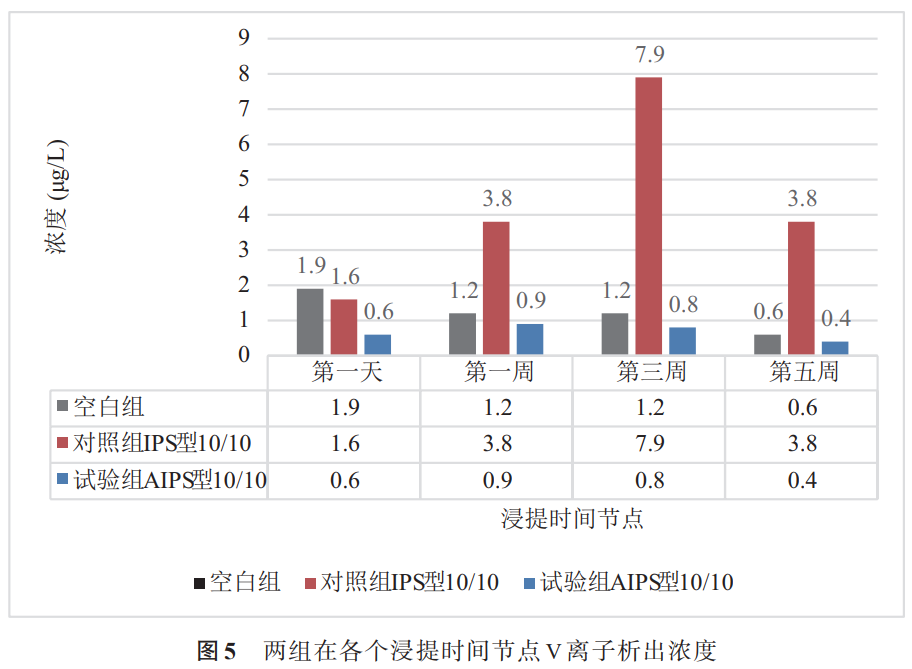
图4和图5为3D打印多孔钛合金阳极氧化前后,在不同浸提时间时Al和V离子的析出浓度(Al:3.6μg/L,V:0.4μg/L)。对照组在第1天时Al离子析出浓度为12.9μg/L,随着浸提时间的增加,Al离子持续析出,在第1周和第3周时,相对于第1天析出量明显升高,浸提时间到第5周时,Al离子析出浓度达到54.6μg/L。在测试的浸提时间点,对照组中V离子的析出量均显著高于试验组。浸提3周时,对照组的V离子析出浓度达到最大值7.9μg/L,约为试验组的10倍。整个测试周期内,试验组浸提液的V离子浓度最低为0.4μg/L,最大值为0.9μg/L,且在每个浸提测试点的测试值均小于对应的空白组测试值。钛合金阳极氧化在表面生成TiO2氧化膜,稳定的TiO2中Ti离子的析出量极为稀少,因此在浸提测试中,试验组和对照组中均未检测到Ti离子析出。
3、讨论
3.1组织结构
通过对着色阳极氧化样品的宏观和显微组织观察,表明着色阳极氧化不会改变3D打印多孔钛合金的结构和显微组织,从而保持其原有的力学性能。
与常规机加工钛合金经着色阳极氧化后的表现一致[23],3D打印的多孔钛合金阳极氧化后其表面元素种类未发生变化,为Ti、O、V、Al,未引入非基体元素,但氧元素含量明显升高,高于氧化前的两倍。这是因为3D打印的多孔Ti-6Al-4V钛合金经过阳极氧化后,表面形成一层更为致密、均匀、透明的氧化膜[24],膜层主要成分为TiO2。
3.2金属离子析出
3D打印多孔Ti-6Al-4V合金作为材质的人工髋关节、人工膝关节和脊柱植入物等假体越来越多的应用于临床[13-16],Al作为Ti-6Al-4V合金中α相稳定元素,V作为β相的稳定元素已成为保证植入力学性能中不可或缺的元素。但是Al和V具有潜在毒性,Al为非人体必需的微量元素,且Al与老年痴呆症有密切关系,Al离子的析出可能引起神经紊乱和贫血等不良症状,因此在生物医学材料中应避免该元素的存在。Hanawa等[25]研究了40余种金属离子在纤维原细胞和成骨细胞中的毒性大小,发现V离子的毒性较大;V对生物体内肾、肝、骨、脾等器官具有毒性作用。李雪峰等[26]研究了3D打印多孔Ti6Al-4V中Ti、Al、V在动物体内的析出行为,检测了实验动物外周血、肝、肾及肌肉组织中的Ti、Al、V金属离子浓度,结果显示动物体内Ti、Al、V的析出量无显著差异,析出的金属离子以Al为主,Ti和V析出量较少,均为微克级,远低于犬骨髓基质干细胞培养液中金属离子浓度,证实了3D打印多孔Ti6Al-4V合金几乎不会影响周边细胞粘附及增殖,提示其具有良好的生物相容性。但是该研究同时说明在外周血中Al离子浓度随着时间延长逐渐升高,Al离子的变化强烈提示了3D打印Ti-6Al-4V在选择基材时应对铝离子加以关注,动物体内Al离子的存在是否导致进一步的毒理病理变化,需要进一步分析。
本文拟通过对多孔Ti-6Al-4V合金进行阳极氧化处理的手段,进一步减少3D打印多孔钛合金中的Al/V离子的析出,从而降低Al和V离子析出的潜在毒性风险。根据相关论著[26,27]研究表明常规机加工工艺的钛合金表面形成的氧化膜利于细胞附着生长,同时保护基体避免腐蚀,本次试验通过对3D打印多孔钛合金进行阳极氧化处理,根据金属离子析出实验结果,阳极氧化后的多孔钛合金样品的浸提液中,Al离子和V离子浓度与未进行阳极氧化的样品浸提液中离子浓度相比,有所降低,也证实阳极氧化能够降低基体腐蚀。其中Al离子浓度在整个测试周期内几乎没有明显变化,Al离子的释放浓度与空白组的测试值差异无统计学意义。阳极氧化的3D打印多孔钛合金中的V离子在模拟体液中几乎不析出。Ti离子在
整个浸提过程中均未检测到。
因此对3D打印多孔钛合金进行阳极氧化,是有效避免Al/V金属离子析出,防止金属离子析出导致毒理病理变化的可行方案,对目前3D打印多孔Ti6Al-4V合金植入器械的阳极氧化处理,是进一步提高植入假体安全性的有益途径。
4、结论
(1)着色阳极氧化的3D打印多孔Ti-6Al-4V钛合金仍然为α+β双相结构,与氧化处理前的显微组织特征一致,阳极氧化不影响3D打印多孔Ti6Al-4V的显微组织结构,因此不会对合金的力学性能造成影响。
(2)着色阳极氧化的3D打印多孔Ti-6Al-4V钛合金表面形貌未发生变化,也不会对多孔结构的丝径和孔径造成影响。表面元素主要为Ti、O、Al和V,阳极氧化未引入非基体元素,由于表面形成TiO2膜,表面成分中O的含量增加。
(3)与阳极氧化前的3D打印多孔Ti-6Al-4V合金相比,着色阳极氧化多孔Ti-6Al-4V钛合金在Hank's模拟人工体液中Al/V离子的析出量显著降低,几乎避免了金属离子的析出。对3D打印多孔Ti-6Al-4V钛合金进行阳极氧化处理是降低或避免Al/V离子析出的有效途径,是进一步提高3D打印钛合金骨科植入物安全性的可行措施。
5、致谢
感谢国家骨科与运动康复临床医学研究中心创新基金重点项目(23-NCRC-CXJJ-ZD1-1)提供的资金支持。
[参考文献]
[1] Zheng YH, Han Q, Wang JC. Promotion of osseointegration between implant and bone interface by titanium alloy porous scaffolds prepared by 3D Printing[J]. ACS Biomater Sci Eng, 2020, 6
(9):5181-5190. [2] Geetha M, Singh AK, Asokamani R, et al. Ti based biomaterials, the ultimate choice for orthopaedic implants-A review[J]. Prog in Maters Sci, 2009, 54:397-425.
[3] Sidambe A. Biocompatibility of advanced manufactured tit a n i um imp l a n ts—A r e v i ew[J]. Me t a ls-Ba s e l, 2014, 7(12):8168-8188.
[4] Liu X, Chu P, Ding C. Surface modification of titanium, tit a n i um a ll o y s, a n d r el a t e d ma t e ri a ls f o r b i ome d i c a l applications[J]. Mater Sci Eng R-Rep, 2004,47(3-4):49-121.
[5] Elias CN, Lima JHC, Valiev M, et al. Biomedical applications of titanium and its alloys [J]. Bio Mat Sci, 2008, 60(3):46-49.
[6] 张先龙, 王坤正.关节外科的未来——数字骨科技术在关 节外科的应用[J].中华骨科杂志, 2021, 41(8):525-531.
[7] 甄珍, 王健, 奚廷斐, 等.3D 打印钛金属骨科植入物应用现 状[J].中国生物医学工程学报, 2019, 38(2):240-251.
[8] Ma ri n E, Fu si S, Pr e ss a c c o M, e t a l. Ch a r a c t e ri z a ti o n of c e llul ar solids in Ti6Al4V for orthopa edi c impl ant a p p li c a ti o n s: Tr a b e c u l a r tit a
n i um[J]. J Me c h Be h a v Biomed Mater, 2010, 3(5):373-381.
[9] 周梦, 成艳, 周晓晨, 等.基于增材制造技术的钛合金医用 植入物[J].中国科学:技术科学, 2016, 46(11):1097-1115.
[10] Yang K, Wang J, Jia L, et al. Additive manufacturing of Ti-6Al-4V lattice structures with high structural integrity u n d e r l a rg e c omp r e ssi v e d e f o rma ti o n[J]. J Ma t Sc i Technol, 2019, 35(2):303-308.
[11] Zhang J, Zhou W, Wang H, et al. 3D-printed surface promoting osteogenic differentiation and angiogenetic factor expression of BMSCs on Ti6Al4V implants and early osseointegration in vivo[J]. J Mat Scie Technol, 2019, 35(2):336-343.
[12] Schmidt C, Kaspar D, Sarkar MR, et al. A scanning electron mi c ros copy study of human ost eobl a st morphology on five orthopedi c me t a ls[J]. J Biomed Ma t e r Re s, 2002, 63(3):252-261.
[13] Baochun Z, Yixin Z, Dejin Y, et al. The utilization of metal augments allows better biomechanical reconstruction of the hip in revision total hip arthroplasty with severe acetabular defects: A comparative study[J]. J Arthroplasty, 2018, 33(12): 3724-3733.
[14] 程文俊, 王俊文, 焦竞, 等.3D 打印钛合金骨小梁金属臼杯 在初次全髋关节置换术应用的临床和影像学评估: 5年临 床随访[J].中华创伤骨科杂志, 2018, 20(12):1066-1071.
[15] Xu N, Wei F, Liu X, et al. Reconstruction of the upper cervical spine using a personalized 3D-printed vertebral body in a n a d o l e s c e n t w i t h e w i n g s a r c
oma[J]. S p i n e, 2016, 41(1):E50-E54.
[16] 郭 卫, 王 毅 飞, 张 熠 丹, 等.3D 打 印 组 配 式 骨 盆 假 体 重 建 骨 盆 肿 瘤 切 除 后 骨缺 损[J].中 华 骨 科 杂 志, 2016, 36(20):1302-1311.
[17] Jonitz-Heincke A, Wieding J, Schulze C, et al. Comparative ana lysis of the oxygen supply and vi ability of human o st e o b l a sts i n t h r e e-d ime n si o n a l t i t a n i um s ca ff o l d s produced by laser-beam or electron-beam melting[J]. Materials, 2013, 6(11): 5398-5409.
[18] Long M, Rack HJ. Titanium alloys in total joint replacement-a materials science perspective[J]. Biomaterials, 1998, 19(18): 1621-1639.
[19] Gulati K, Prideaux M, Kogawa M, et al. Anodized 3D-printed titanium implants with dual micro- and nano-scale topography promote interaction with human osteoblasts and osteocyte-like cells[J]. J Tissue Eng Regen Med, 2017, 11(12):3313-3325.
[20] 安俊波, 樊铂, 宋铎, 等.钛及钛合金表面阳极氧化技术在 医疗器械产品中的应用[J].中国医疗器械信息, 2017, 23(7):40-44.
[21] 朱进清, 李沅, 张晨, 等.外科植入物钛及钛合金阳极氧化 杂质元素分析方法及结果统计分析[J].中国医疗器械 信息, 2021, 27(11):18-20.
[22] GB/T 13810-2017, 外科植入物用钛及钛合金加工材[S].
[23] 张晨, 宋铎, 樊铂, 等.阳极氧化产品表面元素定性分析探 讨[J].生物骨科材料与临床研究, 2014,11(6):76-80.
[24] 张斌英, 郝建民, 陈永楠, 等.TC4 钛合金阳极氧化着色膜 显色规律探讨[J].表面技术, 2020, 5(49):308-316.
[25] Hanawa T. Evaluation techniques of metallic biomaterials in vitro[J]. Sci Technol Adv Materi, 2002, 3(4):289-295.
[26] 李雪峰, 李家林, 梁洁, 等.3D 打印骨小梁髋关节假体材料 在体骨修复及离子析出中的应用[J].医疗装备, 2020, 33(17):1-6.
[27] 韩萍.医用钛及钛合金的阳极氧化工艺研究[D].天津:天 津大学, 2005.
相关链接